
11.已知某溶液中存在H+、OH-、NH4+、Cl-,其离子浓度大小不可能是
A.c(Cl-)=c(NH4+)>c(H+)=c(OH-) B.c(OH-)>c(H+)>c(Cl-)>c(NH4+)
C.c(Cl-)>c(NH4+)>c(H+)>c(OH-) D.c(Cl-)>c(H+)>c(NH4+)>c(OH-)
10.某温度下,在体积为5L的密闭容器中,充入1molA气体,发生如下可逆反应:
2A(g)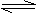 B(g)+ C(g);△H=a
kJ/mol(a>0)2min后反应达到平衡,A为0.4mol。下列叙述不正确的是
B(g)+ C(g);△H=a
kJ/mol(a>0)2min后反应达到平衡,A为0.4mol。下列叙述不正确的是
A.用B物质表示的化学反应速率为0.03mol/(L·min)
B.充分反应后,该反应吸收热量为a/2 kJ
C.达到平衡后,保持温度和容器体积不变,再充入1molA,平衡向正反应方向移动
D.若温度和容器体积不变,起始时充入B、C各0.5mol,则达到平衡时A的物质的量仍为0.4mol
9.锑(Sb)在自然界一般以硫化物的形式存在,从硫化物中提取单质锑一般是先在高温下将硫化物转化为氧化物,再用碳还原:①2Sb2S3 + 3O2 + 6Fe == Sb4O6 + 6FeS
②Sb4O6 + 6C== 4Sb + 6CO,关于反应①、②的说法正确的是
A.反应①、②中的氧化剂分别是2Sb2S3 、 Sb4O6
B.反应①中每生成6molFeS时,共转移6mole-
C.反应②说明高温下Sb的还原性比C强
D.每生成4molSb时,反应①与反应②中还原剂的物质的量之比为1:1
8.下列离子方程式正确的是
A.苯酚钠溶液中通入少量二氧化碳:2C6H5O- + CO2 + H2O == 2C6H5OH + CO32-
B.碳酸氢钙溶液中加入少量烧碱:Ca2+ + 2HCO3- + 2OH- == CaCO3↓ + CO32- + H2O C.新制氯水中滴入少量溴化亚铁溶液:2Fe2+ + 4Br- + 3Cl2 == 2Fe3+ + 2Br2 + 6Cl- D.锌与1mol/LHNO3溶液反应:Zn + 2H+ == 2Zn2+ + H2↑
7.设NA表示阿伏加德罗常数,下列叙述正确的是 ( )
A.0.1mol碳酸钠溶于水所得溶液中所含阴离子数小于0.1NA个
B.标准状况下,0.5molC6H14分子所占体积约是11.2L
C.46克NO2和N2O4混合物中所含的原子总数为3NA
D.足量锌与一定量浓H2SO4充分反应,放出4.48L气体,转移电子数为0.4NA个
6.据中学化学教材所附元素周期表判断,下列叙述中正确的是
A.第1列元素均能形成M+
B.最外层有2个电子的原子都在第2列
C.第15列元素均有气态氢化物RH3
D.第16列元素均有最高价氧化物RO3
29.(16分)芳香化合物M、N互为同分异构体,N的结构简式是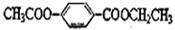
M经①、②两步反应得A、B和C;N经①、②两步反应得C、D和F,上述反应过程、产物性质及相互关系如图15所示。

图15
(1)N可以发生的反应类型有(填序号) 。
①加成反应 ②酯化反应 ③消去反应 ④取代反应 ⑤聚合反应
(2)C中含有官能团的名称是 。
(3)M有两种可能的结构,其对应的结构简式为
、 。
(4)N、A、B、D、E、F化合物中互为同系物的是 。
(5)D→E反应的化学方程式 ,写出D与F反应的化学方程式 。
28.(17分)图14是甲、乙两闰同学研究铜与硝酸反应的装置图,请回答下列问题:
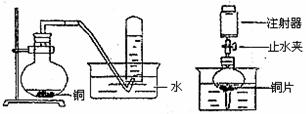
甲 图14 乙
(1)写出铜和稀硝酸反应的化学方程式,用双线桥标出电子转移方向和数目。
(2)实验装置甲能否证明铜和稀硝酸反应产生的是NO气体 (填:能或否),理由是 。
(3)若用实验装置乙进行实验,检查装置气密性的操作是
。在烧杯中加入一下体积的稀硝酸,打开止水夹,用注射器慢慢抽干干燥管内的空气,稀硝酸沿着干燥管慢慢上升,直到充满整个干燥管,停止抽拉注射器,关闭止水夹,观察干燥管内的现象是 。反应停止后打开止水夹,用注射器抽取干燥管内的气体(注射器内原有的空气已排尽)。关闭止水夹后取下注射器,并抽取一定量空气,观察到的现象是 。
(4)上述实验完成后,将注射器内的气体通到NaOH溶液中,目的是
。
27.(12分)120℃,101KPa条件下,有2L H2O、2L C2O、2L CO2、0.5L O2和1L H2组成的混合气体。将混合气体通过分别放有足量Cu分、C粉、CuO粉末的三个灼烧的反应管中,假设气体通过每个反应管都能充分反应,且不论三支反应管以何种顺序排列,问:
(1)尾气是否有可能是单一气体? (填“可能”或“不可能”)。若可能,该气体是 。
(2)原气体中是否有几种(或一种)不可能再存在于尾气之中? (填“有”或“没有”。若有,它们(或它)是 。
(3)原气体中是否有几种(或一种)肯定存在于尾气之中? (填“有”或“没有”。若有,它们(或它)是 。
26.(15分)现有pH=2的盐酸甲和pH=2的醋酸溶液乙(均为常温),请根据下列操作回答问题:
(1)取10mL的乙溶液,加入等体积的水,醋酸的电离平衡 移动(填“向左”、“向右”或“不”);另取10mL的乙溶液,加入少量无水醋酸钠固体(假设加入固体前后,溶液体积保持不变),待固体溶解后,溶液中c(H+)/c(CH3COOH)的比值将 (填“增大”、“减小”或“无法确定”)。
(2)相同条件下,取等体积的甲、乙两溶液,各稀释100倍。稀释后的溶液,其pH大小关系为:pH(甲) pH(乙)(填“>”、“<”或“=”)。
(3)各取25mL的甲、乙两溶液,分别用等浓度的NaOH稀溶液中和至pH=7,则消耗的NaOH溶液的体积大小关系为:V(甲) V(乙)(填“>”、“<”或“=”)。
(4)取25mL的乙溶液,加入等体积pH=12的NaOH溶液,反应后溶液中c(Na+)、
c(CH3COO-)的大小关系 为:c(Na+) c(CH3COO-)(填“>”、“<”或“=”)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com