
13.“绿色奥运”是北京奥运会的主题之一。在北京奥运会上,具有我国自主知识产权的高铁电池电动环保汽车将大量使用。高铁电池是一种新型可充电电池,具有能长时间保持稳定的放电电压的优点。其总反应为:
3Zn+2K2FeO4+8H2O 3Zn(OH)2+2Fe(OH)3+4KOH。
3Zn(OH)2+2Fe(OH)3+4KOH。
下列叙述中不正确的是
A.放电时负极反应为:Zn-2e-+2OH-=Zn(OH)2
B.充电时阳极反应为:Fe(OH)3-3e-+5OH-====FeO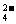 +4H2O
+4H2O
C.放电时正极附近溶液的碱性增强
D.常温下,当500mLpH=13的电解质溶液升高一个单位时,电池中转移了电子1mol
12.某温度下,相同pH的硫酸和硫酸铵溶液中水电离出来的c(H+)分别是1.0×10-a mol·L-1和1.0×10-bmol·L-1,在此温度下,则下列说法正确的是
A.a<b B.a=b
C.水的离子积为1.0×10-(7+a) D.水的离子积为1.0×10-(b+a)
11.短周期元素的离子aW2+、bX+、cY2-、dZ-具有相同的电子层结构,下列推断正确的是
A.原子半径:W>X>Z>Y B.热稳定性:H2Y>HZ
C.离子半径:W2+>Y2- D.碱性:XOH>W(OH)2
10.1820年德贝莱纳用MnO2催化KClO3分解,发现制得的氧气有异常的气味;将所制得的氧气通过淀粉碘化钾溶液,溶液变蓝。氧气可能混有的气体是
A.Cl2 B.Br2 C.NO2 D.CO2
9.下列有关表述中正确的是
A.化学能与热能、电能之间可以相互转化,因此任何化学反应都可以设计成原电池反应
B.使用催化剂既可以提高合成氨反应的速率,又可以提高氨的产率
C.乙烯是重要的化工原料,它主要来自于石油的分馏
D.对于常见的大多数金属,其活泼性越强,冶炼就越困难,被开发利用的时间就越晚
(四)红色物质成分的探究:
甲同学设计了以下三种探究方案:
方案I:取该红色物质溶于足量稀硝酸中,观察溶液颜色的变化。
方案II:取该红色物质溶于足量稀硫酸中,观察现象。
方案III:称得干燥的坩埚的质量为m1g,取红色物质置于坩埚中再称得质量为m2g。
然后将红色物质在空气中充分灼烧至完全变黑,并在干燥器中冷却,再称量,反复多次直到质量不变,称得最后质量为m3g,比较m1、m2、m3。
回答下列问题:
(1)方案I是否合理 (填“合理”或“不合理”)。如果你认为该方案合理,请简述其工作原理;如果你认为该方案不合理,请简述原因。 。
(2)方案II中,若观察不到明显现象,则可知红色物质为 ;若观察到溶液变为蓝色,则可知红色物质为 。
(3)方案III中,如果m1、m2、m3的关系符合m3= ,可确认红色物质为Cu2O。
(4)乙同学利用下列装置设计了第四种探究方案:
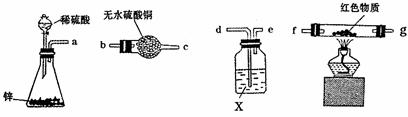
各装置接口的正确连接顺序是( )接( )( )接( )( )接( );试剂X可选用 ;要测定红色物质的成分,最少需要测定的物理量是
(填序号)。
①通入氢气的体积 ②反应前,红色物质+反应管的总质量
③实验前干燥管的质量 ④完全反应后,红色物质+反应管的总质量
⑤反应管的质量 ⑥实验后干燥管的质量
[选做部分]
共8个小题,考生从中选择2个物理题、1个化学题和1个生物题作答。
31.(8分)[化学--化学与技术]
氟化钠是一种重要的氟盐,主要用做农业杀菌剂、杀虫剂和木材防腐剂。实验室可通过下图所示的流程,以氟硅酸(H2SiF6)等物质为原料制取氟化钠,并得到副产品氟化铵。
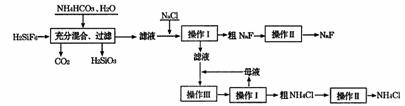
有关物质在水中的溶解度分别为:
氯化铵:10℃时33.3g;20℃时37.2g;30℃时41.4g。
氟化钠:20℃时4g。
氟硅酸钠(Na2SiF6)微溶于水。
请回答下列问题:
(1)上述流程中发生了两步化学反应,第二步制取NaF的反应的化学方程式为NH4F+NaCl=NH4Cl+NaF↓;此反应能进行是因为NaF的溶解度比NaCl ;
(2)操作I所需要用到的玻璃仪器除玻璃棒外,还有 ;
(3)操作II的名称是 ;
(4)操作III的具体过程是 ;
(5)流程中NH4HCO3必须过量,其原因是 。
32.(8分)[化学--物质结构与性质]
W、X、Y、Z四种短周期元素的原子序数依次增大。其中X原子的价电子构型为2s22p2,Y原子的L电子层中,有三个未成对的电子,且无空轨道;W、Z的原子序数相差10,且Z原子的第一电离能在同周期中最低。
回答下列问题:
(1)写出Y元素基态原子的最外层电子轨道表示式 ;
(2)WXY分子中的三个原子除W原子外均为8电子构型,写出该分子的结构简式 ,根据电子云重叠方式的不同,分子里共价键的主要类型有 ;
(3)YW3分子是一种常见气体,分子中Y原子的杂化方式是 ;该物质易液化,极易溶于水,其原因是 ;
(4)液态的YW3也是一种重要的溶剂,其性质与H2O相似,Z的单质与液态YW3反应化学方程式为 。
33.(8分)[化学--有机化学基础]
与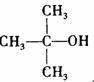 结构相似的醇不能被氧化为醛或酮。“智能型”高分子在生物工程中有 广泛的应用前景,PMAA就是一种“智能型”高分子,可应用于生物制药中大分子和小分子的分离。下列是以物质A为起始反应物合成PMAA的路线:
结构相似的醇不能被氧化为醛或酮。“智能型”高分子在生物工程中有 广泛的应用前景,PMAA就是一种“智能型”高分子,可应用于生物制药中大分子和小分子的分离。下列是以物质A为起始反应物合成PMAA的路线:
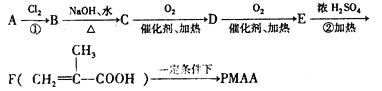
回答下列问题:
(1)分别写出A和PMAA的结构简式:A ;PMAA ;
(2)上述过程中①、②的反应类型分别是:① ,② ;
(3)写出反应C→D的化学方程式 ;
(4)化合物G满足以下关系:a. 分子中无支链碳原子;b. 与E含有相同的官能团,且与E互为同分异构体;c. 可发生分子内脱水生成五元环酯类化合物H。写出反应C→H的化学方程式 。
(三)制备红色物质:方法同初中课本
(二)查阅资料:①Cu2+在酸性条件下能发生自身氧化还原反应(Cu2O+2H+ =Cu2++Cu+H2O);②在空气中灼烧Cu2O能生成CuO。
(一)提出猜想:红色物质可能是铜、氧化亚铜或两者的混合物。
9.下列行为中不利于保护地球环境的是 ( )
A.研发可降解塑料,控制白色污染
B.植树造林,控制工业废水的排放
C.加强新能源研究,使用压缩天然气、氢气作汽车燃料
|
10.下列说法中不正确的是 ( )
A.乙烷、乙醇和乙酸都能发生取代反应
B.苯分子中没有乙烯分子中的双键结构,因此苯不能发生加成反应
C.可用新制的Cu(OH)2悬浊液检验患者的尿液中是否含糖
D.蛋白质溶液中加入饱和(NH4)2SO4溶液后蛋白质会析出,再加水可溶解
11.同温同压下,下列各热化学方程式中反应热数值最小的是 ( )
A.2A(l)+B(l)=2C(g) △H=+Q1kJ·mol-1
B.2A(g)+B(g)=2C(g) △H=+Q2kJ·mol-1
C.2A(g)+B(g)=2C(l) △H=+Q3kJ·mol-1
D.2A(l)+B(l)=2C(l) △H=+Q4kJ·mol-1
12.下列说法中正确的是 ( )
A.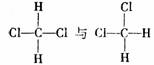 互为同分异构体
互为同分异构体
B.HF、HCl、HBr、HI的热稳定性依次增强
C.升高饱和石灰水的温度时,Ca(OH)2的溶度积常数Ksp减小
D.常温下,pH=1的溶液中,Ba2+、Na+、I-、NO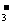 可以大量共存
可以大量共存
13.某溶液中只有Na+、CH3COO-、H+、OH-四种离子,且浓度大小的顺序为: c(CH3COO-)>c(Na+)>c(H+)>c(OH- ) ,下列说法正确的是 ( )
A.该溶液由pH =3的CH3COOH与pH =11的NaOH溶液等体积混合而成
B.在该溶液中加入适量的CH3COONa,可使溶液中离子浓度大小顺序改变为: c(Na+)> c(CH3COO-) >c(H+)>c(OH- )
C.在该溶液中加入适量NaOH,可使溶液中离子浓度大小改变为:
c(CH3COO-)>c(Na+)>c(OH-)>c(H+)
D.由0.1 mol/L的CH3COOH与0.1 mol/L等体积的NaOH溶液混合而成
14.X、Y、Z为短周期元素,Z的原子序数等于X、Y的原子序数之和,且Z离子比X离子多三个电子层,下列推断不正确的是 ( )
A.Y的原子半径大于Z的原子半径 B.X可能为金属元素
C.Y与Z不可能形成离子化合物 D.Z一定为非金属元素
15.已知氯化铁溶液能与碘化钾反应生成氯化亚铁、氯化钾和碘单质。某溶液中含有的溶质是FeBr2、FeI2,若向该溶液中通入一定量的氯气,再向反应后的溶液中滴加KSCN溶液,结果溶液变成血红色。则下列叙述正确的是 ( )
①原溶液的Br-一定被氧化; ②通入氯气后溶液中的Fe2+一定被氧化; ③不能确定通入氯气之后的溶液中是否存在Fe2+; ④若取少量所得溶液,再加入CCl4充分振荡后静置,向上层溶液中加入足量的AgNO3溶液,只产生白色沉淀,说明原溶液中的Fe2+、Br-、I-均被完全氧化。
A.只有②③ B.①②③④ C.只有①④ D.只有②③④
|
[必做部分]
28.(12分)已知NO2和N2O4可以相互转化:N2O4(g) 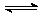 2NO2(g) △H<0,现将一定量NO2和N2O4的混合气体,通入体积为1L的恒温密闭容器中,各物质浓度随时间变化关系如下图所示:
2NO2(g) △H<0,现将一定量NO2和N2O4的混合气体,通入体积为1L的恒温密闭容器中,各物质浓度随时间变化关系如下图所示:
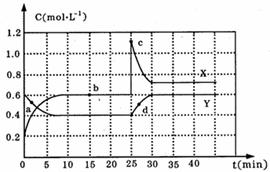
请回答下列问题:
(1)图中共有两条曲线X和Y,其中表示N2O4浓度随时间变化的曲线是 ;
(2)前10min内,v(N2O4)= ;
(3)a、b、c、d四个点中,表示化学反应处于平衡状态的是 ,此时反应的平衡常数为 ;
(4)反应进行到25min时,曲线发生变化的原因是 ;若要达到最后相同的化学平衡状态,在25min时还可以采取的措施是 (填序号)。
A.升高温度 B.缩小容器体积 C.加入催化剂 D.加入一定量的N2O4
29.(13分)有A、B、C三种短周期元素,它们的原子序数依次增大,B元素原子最外层电子数是C元素原子最外层电子数的一半,A元素原子最外层电子数比B元素原子最外层电子数多一个。甲、乙、丙依次是A、B、C三元素最高价含氧酸的钠盐,甲、乙溶液pH>7,丙溶液pH<7;丁为气体,戊为淡黄色固体。
甲、乙、丙、丁、戊、己六种物质之间的相互反应关系如下图(部分产物已略去):
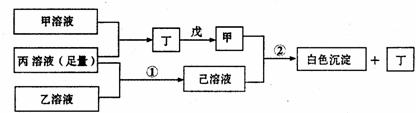
(1)A的元素名称为 ,C元素的简单离子结构示意图为 ;
(2)写出反应①的离子方程式 ;
(3)甲溶液中所有离子的浓度由大到小的顺序为 ;
(4)将两个铜电极插入丙溶液中进行电解,开始时发生的离子方程式为 ;
(5)写出反应②的化学方程式 。
30.(17分)铜有Cu2O(红色)和CuO(黑色)两种常见的氧化物。某高中化学兴趣小组的同学对初中课本实验的结论“H2与CuO反应生成红色物质Cu”提出质疑,认为生成的红色物质不一定就是铜。为了确定该红色物质的成分,该兴趣小组开展了以下研究。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com