
2. 古诗词是古人为我们留下的宝贵精神财富,下列诗句不涉及氧化还原反应的是
A.野火烧不尽,春风吹又生 B.春蚕到死丝方尽,蜡炬成灰泪始干
C.粉身碎骨浑不怕,要留青白在人间 D.爆竹声中一岁除,春风送暖入屠苏
1.2008夏季奥运会将在我国举行,这次奥运会要突出“绿色奥运、科技奥运、人文奥运”的理念,其中“绿色奥运”是指
A.把环境保护作为奥运设施规划和建设的首要条件
B.严禁使用兴奋剂,使运动员公平竞争
C.所有奥运用品和食品全都是绿色的
D.奥运场馆建设均使用天然材料,不使用合成材料
33.(8分)已知溴水中存在化学平衡:Br2+H2O HBr+HBrO,乙烯通入溴水中,生成A、B和C2H5Br三种物质。
HBr+HBrO,乙烯通入溴水中,生成A、B和C2H5Br三种物质。
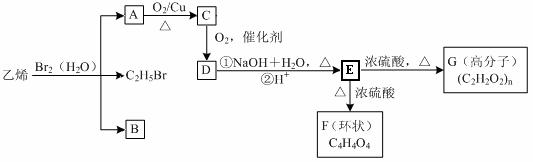
回答下列问题:
(1)在上述有机物中,能发生银镜反应的物质的结构简式为_____________,
(2)反应EF的基本反应类型是:__________________,
(3)写出由E转化为G的化学方程式:_________________________________________,
(4)若由B为原料制备化学式为(C4H4O4)n的高聚物,请仿照上图形式写出流程示意图。
32.(8分)请完成下列各题:
(1)铬(24Cr)原子基态的电子排布式_____________________,
(2)氢原子得到电子放出的能量为72.8 kJ·mol-1,氢原子基态的第一电离能为1312.0 kJ·mol-1,氢负离子H-的第一电离能是:__________________。
(3)镁原子基态的第一电离能为738 kJ·mol-1,则铝原子的第一电离能(填“>”或“<”或“=”) 738 kJ·mol-1,
(4)将第二周期元素A与氢形成的下列化合物中A-A键的键能,按由大到小的顺
序为:CH3-CH3>H2N-NH2>HO-OH,其原因是:
______________________________ ____________
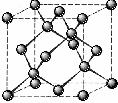
(5)常见单质硅的晶体结构与金刚石的结构一样(晶胞如下图),若每2个硅原子之间加上一个氧原子,就形成了空间网状结构的二氧化硅。请指出二氧化硅每1个晶胞含有_________个硅氧键(Si-O)。
[化学-有机化学基础]
31.(8分)工业上对海水资源合开发利用的部分工艺流程如下图所示。
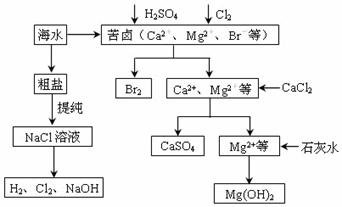
(1)电解饱和食盐水常用离子膜电解槽和隔膜电解槽。离子膜和隔膜均允许通过的离子是 。电解槽中的阳极材料为 。
(2)本工艺流程中先后制得Br2、CaSO4和Mg(OH)2,能否按Br2、Mg(OH)2、CaSO4顺序制备?原因是 。
(3)溴单质在四氧化碳中的溶解度比在水中大得多,四氧化碳与水不互溶,固可用于萃取溴,但在上述工艺中却不用四氧化碳,原因是
。
[化学-物质结构与性质]
30.(18分)某学习兴趣小组探究废干电池(锌筒内填有炭粉、MnO2、NH4Cl等的糊状物)的回收利用,并用回收的物质进行如下实验。
I.(1)从废干电池中提取NH4Cl。
① 利用该糊状物提取NH4Cl前两步的操作为:a.溶解 b. 。
② 甲同学设想:将分离出的NH4Cl溶液蒸发、结晶、灼烧,就可以制得纯净的NH4Cl。请对甲同学的方案作出评价并说明理由:______________________________________
。
(2)制取氨气。
① 乙同学要制备并收集到纯净的氨气,下列各反应及操作中合理的是
a.将氯化铵固体加热分解 b.将浓氨水滴入氢氧化钠固体中
c.将氢氧化钠固体加入浓氨水中 d.将氯化铵浓溶液滴入氢氧化钠固体中
② 乙同学认为将集气瓶正放在桌上(如图所示),就可以收集到纯净的氨气。
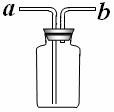
你若认为可行,请说明其操作:_____________________________。
你若认为不可行,请说明其理由:___________________________。
Ⅱ.丙同学利用上面得到的氨气制取氨水并进行了如下探究实验:
(3)为探究NH3·H2O是否是弱电解质。
丙同学设计方案如下:① 将1.12L(标况)NH3完全溶于水,配得溶液500mL;
② ;③分析数据,即
可得出结论。
请把最简单的实验步骤②,填写在上面的空格中。
(4)探究氨水与盐酸的反应过程。
丙同学进行了如下实验:向25mL上述氨水中逐滴滴加同浓度的盐酸,测定反应过程中溶液pH并绘制其pH变化曲线(如图)。请回答:
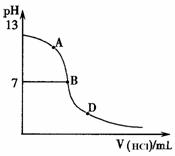
①酸碱恰好完全中和时的pH点应是_________
(填A或B或D),此时溶液中c(NH3·H2O)+c(NH4+)=______mol·L-1,溶液中
各离子的浓度由大到小的顺序为 。
III.请参与探究
(5)请完成以下探究实验报告。
[探究课题]比较在25℃、0.1mol·L-1的NH3·H2O溶液和0.1mol·L-1的NH4Cl溶液中,NH3·H2O的电离程度与NH4+水解程度的相对大小。
[探究方案]
[选做部分]
共8题,考生必须从中选择2个物理题、1个化学题和1个生物题在答题纸规定的区域作答。
[化学-化学与技术]
29.(14分)将1molH2与2mol CO2的混合气体通入容积为2L的密闭容器中,发生如下化学反应:CO2(g)+ H2(g) CO(g)+ H2O(g)
△H = Q kJ·mol-1
CO(g)+ H2O(g)
△H = Q kJ·mol-1
测得其化学平衡常数K和温度t的关系如下:
|
t℃ |
700 |
800 |
850 |
|
K |
0.6 |
0.9 |
1.0 |
(1)请回答:
①上述反应中Q 0 (选填“>”或“<”或“=”)。
②在恒温下,能判断该反应已达到化学平衡状态的依据是 。
a.容器中压强不变
b.该反应的反应热△H不变
c.H2的质量分数不再变化
d.单位时间内生成H2O的物质的量与生成CO2的物质的量相等
(2)850℃时,向2L的密闭容器中通入1mol CO 和 m mol H2O,当反应达到平衡时,平衡混合物中n(H2O)=2n(H2),则m=_________。
(3)850℃时,向2L的密闭容器中通入2mol CO 和 4 mol H2O,当反应达到平衡时,
n (H2)=_________。
(4)850℃时,,向2L的密闭容器中通入a mol CO、b mol H2O、c mol CO2和d molH2。
①若要求反应达到平衡时H2的物质的量分数与(3)的相同,则a、b、c、d之间应满足的关系是:_________________________。
②若要求反应向生成H2的方向进行,则a、b、c、d之间应满足的关系是: _____________。
28.(10分)在四川的抗震救灾中,大量的化学试剂和药品发挥了很好的保障生活、防疫治病的作用。
(1)人的生活和生命都离不开食盐。将下列关于氯化钠的描述进行分类:
①氯化钠是由钠元素和氯元素组成的
②氯化钠在维持人体内的电解质平衡中起重要作用
③氯化钠是常用的调味品
④氯化钠中钠离子和氯离子的个数相等
可将上述四项分成两类,则分类的依据分别是______________、_______________。
(2)救灾首先要保证人畜的饮用水清洁无菌。高铁酸钾(K2FeO4)是一种比Cl2、O3化学性质更强、用途更广、无二次污染的多功能绿色水处理剂,其制备反应:
2Fe(OH)3+3ClO-+4OH-===2FeO42-+3Cl-+5H2O。
其消毒净水的反应原理为:FeO42- Fe3+ Fe(OH)3。请回答:
①每生成1 mol K2FeO4转移电子 。
②K2FeO4能消毒是由于其具有 。
③K2FeO4能净水是由于产物能形成 ,吸附悬浮物,其净水过程_________
a.只有物理过程 b.只是化学过程 c.是物理和化学过程
(3)AlCl3也是常用的净水剂,其产物Al(OH)3既能溶于强酸溶液也能溶于强碱溶液,请用必要的方程式和文字从反应原理的角度予以说明。
15.在t℃时,将a gNH3完全溶于水,得到V mL溶液,假设该溶液的密度为ρg·cm-3,
质量分数为ω,其中含NH4+的物质的量为b moL。下列叙述中正确的是
A.溶质的质量分数为ω=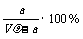
B.溶质的物质的量浓度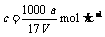
C.溶液中c(OH-)=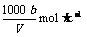
D.上述溶液中再加入VmL水后,所得溶液的质量分数大于0.5ω
第Ⅱ卷
[必做部分]
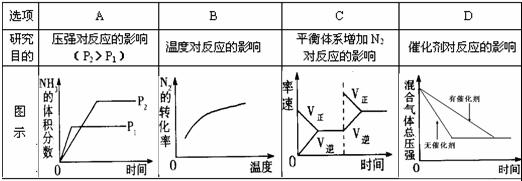
14.对于可逆反应N2(g)+3H2(g) 2NH3(g);△H<0,在其它条件不变的前提下,下列研究目的和示意图相符的是
2NH3(g);△H<0,在其它条件不变的前提下,下列研究目的和示意图相符的是
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com