
2、用铁片与稀硫酸反应制取氢气时,下列措施不能使氢气生成速率加快的是
A、滴加少量CuSO4溶液 B、不用稀硫酸,改用98%的浓硫酸
C、对该反应体系加热 D、不用铁片,改用铁粉
1、下列反应既是氧化还原反应,又是吸热反应的是
A、铝片与稀硫酸反应 B、Ba(OH)2•8H2O与NH4Cl反应
C、灼热的炭与二氧化碳反应 D、甲烷在氧气中燃烧
31. 向含有1mol明矾的水溶液中滴加氢氧化钡溶液至过量。
(1)当滴入氢氧化钡1.72mol 时,所有沉淀物质的量是多少?质量是多少?
(2)在直角坐标系中作出每一种沉淀的物质的量随氢氧化钡物质的量变化的曲线。
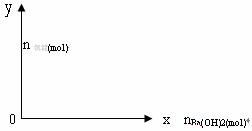
(3)若滴入氢氧化钡的物质的量为x (mol) ,所有沉淀物的物质的量为y (mol) ,质量为m (g) ,请写出数学表达式。
|
x 的取值范围 |
y =f (x) |
m = f (x) |
|
|
|
|
(4)求出y (mol)与m (g)的最大值。
30. 氯化亚铜(CuCl)是重要的化工原料。国家标准规定合格CuCl产品的主要质量指标为CuCl的质量分数大于96.50%。工业上常通过下列反应制备CuCl:
2CuSO4 + Na2SO3 + 2NaCl + Na2CO3 → 2 CuCl ↓ + 3Na2SO4 + CO2 ↑
(1) CuCl制备过程中需要配置质量分数为20.0%的CuSO4溶液,该溶液所需的
CuSO4 · 5H2O与H2O的质量之比为_____________________ 。
(2) 准确称取0.2500gCuCl样品置于一定量的0.5mol/L FeCl3 溶液中,待样品完全溶解后, 加水20 ml ,用0.1000mol/L的Ge (SO4)2溶液滴定到终点,消耗24.60 ml Ge (SO4)2溶液。有关化学反应为:Fe3+ + CuCl → Fe2+ + Cu2+ + Cl- 、 Ge4+ + Fe2+ → Fe3+ + Ge3+ 。通过计算说明上述样品中的质量分数是否符合标准。
29. 近几年来全世界石油价格屡创新高,其主要原因是随着社会生产的发展,人口增多,对能源的需求量逐年增加,全球石油储量下降。寻求和制备代号称“黑金”的新能源已经成为紧迫任务,化学工作者正在研究以天然气和醇类合成优质汽油的方法。已知:
(1)凡与醛基直接相连的碳原子上的氢称为α一H原子,在稀碱溶液的催化作用下,一个醛分子上的α一H原子连接到另一个醛分子的氧原子上,其余部分连接到羰基碳原子上生成羟基醛,如:
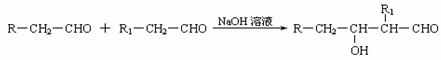
合成路线如下:

|
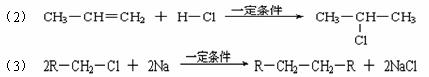
(2)在反应②-⑦中,属于加成反应的是 ,属于消去反应的是 。
(3)写出下列 。
(4)H也能与NaOH水溶液反应,其反应方程式为_______________________________ ,生成的有机物能否在Cu或Ag作催化剂的条件下被氧气氧化生成其它有机物 (选填“能”或“否”)。
28. 莽草酸是合成治疗禽流感的药物--达菲(Tamiflu)的原料之一。莽草酸是A的一种异构体。A的结构简式如下图:
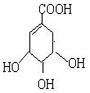
(1)A的分子式是 。
(2)A与溴的四氯化碳溶液反应的化学方程式(有机物用结构简式表示)是 __________________ 。
(3)A与氢氧化钠溶液反应的化学方程式(有机物用结构简式表示)是 。
(4)A在浓硫酸作用下加热可得到B(B的结构简式为HO- -COOH),其反应类型是
。
-COOH),其反应类型是
。
(5)B的同分异构体中既含有酚羟基又含有酯基的共有 种,写出其中一种同分异构体的结构简式 。
27. 某校化学课外小组用硫酸铁废液(含少量硫酸铜和稀硫酸),制备硫酸亚铁晶体并进行如下实验。制备硫酸亚铁晶体主要的操作流程如下:
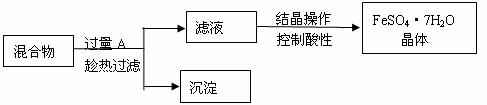
请根据题目要求回答下列问题:
(1)A的化学式为 ,上述操作过程中用到的玻璃仪器有:①烧杯、②玻璃棒、③酒精灯、④温度计、⑤ 。
(2)趁热过滤的目的是 。
(3)结晶操作过程中应控制滤液酸性的原因是 。
(4)已知硫酸亚铁铵[(NH4)2Fe(SO4)2]比硫酸亚铁稳定,常用在分析化学中。硫酸亚铁铵可用硫酸铵和硫酸亚铁反应制得。实验室利用硫酸亚铁铵溶液和草酸溶液反应生成草酸亚铁沉淀来制备草酸亚铁。写出硫酸亚铁铵溶液与草酸溶液反应的离子方程式
________________________________________________ 。
(5)草酸亚铁晶体(相对分子质量180)受热易分解,某课外小组设计如图的实验装置来检验其分解产物。
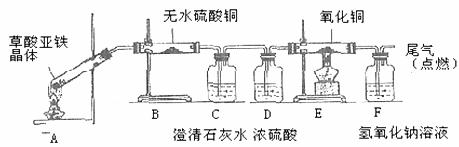
①该装置中最不合理的部分 (填字母),原因是 。
②改用正确装置实验开始后,B处变蓝,说明草酸亚铁晶体中有 ;C处有白色沉淀,E处部分黑色粉末变为红色,说明草酸亚铁分解产生 (填化学式)。
26.为测定碳酸钙纯度(设含杂质SiO2),学生设计了如下几个实验方案,请回答每个方案中的问题。
[方案I](1)称取碳酸钙样品 M g ;(2)加入过量盐酸;(3)收集并测定生成的气体体积V mL。
问题:如果称量样品时,砝码底部有一处未被实验者发现的残缺,那么测定的碳酸钙的纯度会 (偏高、偏低、无影响)
[方案II](1)称取碳酸钙样品 M g;(2)用c mol/L 盐酸 V mL(过量)溶解样品;(3)取溶解后的溶液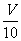 mL,用C′mol/L NaOH溶液滴定,恰好用去V′mL。
mL,用C′mol/L NaOH溶液滴定,恰好用去V′mL。
问题1:列出本实验中必须用到的仪器名称(除铁架台及附件、烧杯、托盘天平(砝码)、药匙之外)
问题2:加盐酸后是否需要滤出SiO2后再用NaOH滴定
A.需要 B.不需要 C.均可
问题3:碳酸钙纯度计算公式
[方案Ⅲ](1)称取碳酸钙样品 M g;(2)高温(1000℃)煅烧直至质量不再发生变化,冷却后称量,质量为M′g。
问题1:为什么要煅烧至1000℃且“直至质量不再改变”?
问题2:本方案中的“冷却”应如何操作
综上所述,你认为3个方案中,最好的方案是 ,其它方案的缺点分别是:
方案 ;
方案 ;
25.铜既能与稀硝酸反应,也能与浓硝酸反应,当铜与一定浓度硝酸反应时,可将方程式表示为:Cu+HNO3 → Cu(NO3)2+NO↑+NO2↑+H2O (方程式未配平)
(1) 硝酸在该反应中的作用是 ,该反应的还原产物是 。
(2) 0.3mol Cu被硝酸完全溶解后,Cu失去的电子数是__________ 个,如果得到的NO和NO2物质的量相同,则参加反应的硝酸的物质的量是 ,若用排水法收集这些气体,可得标准状况下的气体体积 。
(3) 如果参加反应的Cu和HNO3的物质的量之比是3:10,写出并配平该反应的离子方程式_____________________________________。
(4) 如果没有对该反应中的某些物质的比例作限定,则方程式可能的配平系数有许多组。原因是_____________________________________。
24. 500℃、20 MPa时,将H2和N2置于一容积为2 L的密闭容器中发生反应。反应过程中H2、N2和NH3物质的量变化如图所示,根据题意完成下列各题:
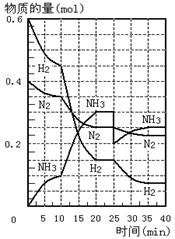
( 1 ) 反应达到平衡时,平衡常数表达式 K=___________________ 此时增加N2的量,平衡常数将______________(填“增大”“减小” 或 “不变”)
( 2 ) 500℃、20 MPa时,反应处于平衡状态的时间______________________________ 。
( 3 ) 反应开始到第一次平衡时,N2的平均反应速率为_______________________________。
( 4 ) 据图判断,反应进行到10 min至20 min时曲线发生变化的原因是: _____________ ;反应进行至25min时,曲线发生变化的原因是: __________________________________ 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com