
12、常温时0.1mol·L-1HA溶液的pH>1,0.1mol·L-1BOH溶液中c(OH-)/c(H+)=1012,将两溶液等体积混合,以下判断正确的是
A、c(H+)< c(OH-)< c(A-)< c(B+) B、c(OH-)< c(H+)< c(B+) < c(A-)
C、c(H+)+ c(B+)= c(A-)+ c(OH-) D、c(A-)= c(B+)> c(H+)= c(OH-)
11、下列措施中能够使反应Cu + 2H2O = Cu(OH)2 + H2↑得以实现的是
A、铜片作原电池的负极,碳棒作原电池的正极,氯化钠作电解质溶液
B、铜锌合金在潮湿的空气中发生电化学腐蚀
C、用铜片作阴、阳电极,电解稀硫酸
D、用铜片作阳极,铁作阴极,电解硫酸钠溶液
10、在一定温度下的定容密闭容器中,当下列物理量不再变化时,表明反应:
A(固)+2B(气) C(气)+D(气)已达平衡的是
C(气)+D(气)已达平衡的是
A、混合气体的压强 B、混合气体的密度
C、气体总物质的量 D、B的物质的量浓度
9、短周期元素X、Y、Z在周期表中的位置如图所示,则下列说法正确的是
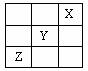
A、X是活泼的非金属
B、三种元素中Y的非金属性最强
C、Z的最高价氧化物的水化物是强酸
D、Y的最高价氧化物的水化物是一种强酸
8、碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌-锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)==Zn(OH)2(s)+Mn2O3(s),下列说法不正确的是
A、外电路中每通过0.2mol电子,锌的质量理论上减小6.5g
B、电池工作时,电子由正极通过外电路流向负极
C、电池正极的电极反应式为:2MnO2(s)+H2O(1)+2e-=Mn2O3(s)+2OH-(aq)
D、电池工作时,锌失去电子
7、某溶液中水电离的C(H+)=10-12mol/L,在该溶液中一定能够大量存在的离子组是
A、Fe2+、NO3-、Cl-、HCO3- B、S2-、CO32-、K+、NH4+
C、Ba2+、Cl-、NO3-、Na+ D、F-、Ca2+、Cl-、Na+
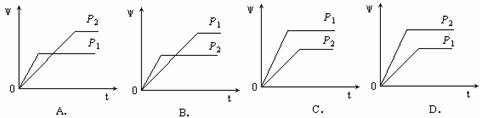
6、在一定温度不同压强(p1<p2)下,可逆反应2X(g)  2Y(g) + Z(g)中,生成物Z在反应混合物中的体积分数(ψ)与反应时间(t)的关系有以下图示,正确的是
2Y(g) + Z(g)中,生成物Z在反应混合物中的体积分数(ψ)与反应时间(t)的关系有以下图示,正确的是
5、下列过程或现象与盐类水解无关的是
A、纯碱溶液去油污 B、浓硫化钠溶液有臭味
C、加热氯化铁溶液颜色变深 D、铁在潮湿的环境下生锈
4、下列说法中正确的是
A、离子化合物中可能存在非极性共价键
B、由两种非金属元素形成化合物中不可能含有非极性共价键
C、锂与钠位于同一主族,因此锂在空气燃烧的产物是Li2O2
D、离子化合物中肯定含有金属元素
3、甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g); △H= + 49.0 kJ·mol-1
②CH3OH(g)+1/2O2(g)=CO2(g)+2H2(g);△H= -192.9 kJ·mol-1
下列说法正确的是
A、CH3OH的燃烧热为192.9 kJ·mol-1
B、反应①中的能量变化如下图所示
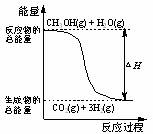
C、CH3OH转变成H2的过程一定要吸收能量
D、根据②推知反应: CH3OH(l)+1/2O2(g)=CO2(g)+2H2(g)的△H>-192.9kJ·mol-1
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com