
6.下列叙述不正确的是 ( )
A.北京奥运会的火炬“祥云”的燃料是丙烷,它是甲烷的同系物
B.在打捞“南海一号”沉船时,发现明代铝制餐具
C.发射“嫦娥一号”卫星的火箭燃料中,氧化剂四氧化二氮的还原产物是氮气
D.抗冰雪灾害时使用的融雪剂所含的氯化钠、氯化镁、氯化钙等都属于无机盐类
31.在120℃,101kPa条件下,由H2、CH4、CO组成的混合气体amL,通入一定量(设为xmL)氧气使其完全燃烧。
(1)若a mL混合气体完全燃烧消耗相同条件下氧气的体积也为amL(即x=a),则原混合气体中CH4的体积分数是 ;
(2)若完全燃烧后生成CO2和H2O(g)的总体积在相同条件下为2a mL,则原混合气体中CH4的体积分数是 ,现要测定原混合气体中H2的体积分数,还必须知道相同条件下其它数据可以是 (填选项字母);
A.2a mL混合气体的密度
B.生成CO2气体的总体积
C.生成H2O(g)的总质量
(3)若原混合气体完全燃烧时,生成的气体中只有CO2和H2O(g),则x的取值范围是 。
30.某课外兴趣小组为了探究碱性溶液中Mg2+、AlO-与溶液pH的关系,进行下列实验:向含有0.1 mol HCl、0.1 mol MgCl2、1.0 mol AlCl3的混合溶液中逐渐加入NaOH溶液,均至反应后溶液体积1 L。测得部分实验数据如下表:
|
pH |
9 |
10 |
11 |
|
c(Mg2+)/ mol·L-1 |
10-1 |
10-3 |
10-5 |
|
c(AlO2―)/mol·L-1 |
10-2 |
10-1 |
1 |
试回答:
(1)向混合溶液中加入NaOH溶液至pH=9,能否有Mg(OH)2沉淀出现__________(填“能”或“否”),由此你得到的初步结论是___________________________________。
(2)向混合溶液中加入NaOH溶液至pH=10,需要NaOH溶液中有多少克NaOH?(最后结果保留两位小数)
29.已知:①醛在一定条件下可以两分子加成:

产物不稳定,受热即脱水而成为不饱和醛。
②B是一种芳香族化合物。根据下图所示转化关系填空(所有无机物均已略去)

(1)写出B、F的结构简式:B ;F 。
(2)写出②和③反应的反应类型:② ;③ 。
(3)写出G、D反应生成H的化学方程式: 。
(4)F若与H2发生加成反应,每摩F最多消耗的H2的物质的量为 mol。
28.环丙烷可作为全身麻醉剂,环己烷是重要的有机溶剂。下面是部分环烷烃及烷烃衍生物的结构简式、键线式和某些有机化合物的反应式(其中Pt、Ni是催化剂)
|
结构简式 |
 |
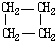 |
Br-CH2-CH2-CH(CH3)-CH2-Br |
|
键线式 |
 (环己烷) (环己烷) |
 (环丁烷) (环丁烷) |
 |

回答下列问题:
(1)环烷烃与 是同分异构体。
(2)从反应①-③可以看出,最容易发生开环加成反应的环烷烃是 (填名称),判断依据为 。
(3)环烷烃还可与卤素单质、卤化氢发生类似的开环加成反应,如环丁烷与HBr在一定条件下反应,其化学方程式为 (不需注明反应条件)
(4)写出鉴别环丙烷与丙烯的一种方法,试剂 ;现象与结论 。
27.化学课上老师做了一个演示实验:用脱脂棉包住约0.2g过氧化钠粉末,置于石棉网上,往脱脂棉上滴水,观察到脱脂棉剧烈燃烧起来。
(1)由上述实验现象所得出的有关过氧化钠跟水反应的结论是:
第一:有氧气生成;第二: 。Na2O2跟水反应的化学方程式是 。
(2)某研究性学习小组拟用下图所示装置(气密性良好)进行实验,以证明上述结论。
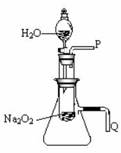
用以验证第一条结论的实验操作是: _________;
用以验证第二条结论的实验方法是: _________ 。
(3)实验(2)往试管中加水至固体完全溶解且不再有气泡生成后,取出试管,往试管中滴入酚酞试液,发现溶液先变红后褪色。为探究其原因,该小组同学从查阅有关资料中得知:Na2O2与水反应可生成H2O2,H2O2具有强氧化性和漂白性。请设计一个简单的实验,验证Na2O2跟足量水充分反应后的溶液中有H2O2存在。(只要求写出实验所用的试剂及观察到的现象)
试剂: ;现象: 。
(4)该小组同学提出用定量的方法探究Na2O2跟水反应后的溶液中否含有H2O2,其实验方法为:称取2.6g Na2O2固体,使之与足量的水反应,测量产生O2的体积并与理论值比较,即可得出结论。
①测量气体体积时,必须待试管和量筒内的气体都冷却至室温时进行,应选用下图装置中的
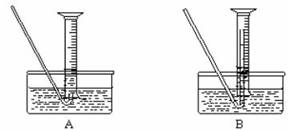
(忽略导管在量筒中所占的体积) (填序号),理由是 。
②若在标准状况下测量气体的体积,应选用的量筒的大小规格为 (选填“100mL”“200 mL”“500 mL”或“1000 mL”)。
26.实验室制备溴乙烷(C2H5Br)的装置和步骤如下图:(已知溴乙烷的沸点38.4℃)
①检查装置的气密性,向装置图所示的U形管和大烧杯中加入冰水;

②在圆底烧瓶中加入10mL95%乙醇、28mL78%浓硫酸,然后加入研细的13g溴化钠和几粒碎 瓷片;
③小心加热,使其充分反应。
回答下列问题:
(1)该实验制取溴乙烷的化学方程式为:______________________________________。
(2)反应时若温度过高,可看到有红棕色气体产生,该气体分子式为___________,同时生成的无色气体分子式为_______________。
(3)为了更好的控制反应温度,除用图示的小火加热,更好的加热方式是__________。
(4)U型管内可观察到的现象是_____________________________。
(5)反应结束后,U形管中粗制的C2H5Br呈棕黄色。为了除去粗产品中的杂质,可选择下列试剂中的_________________(填序号)。
A.NaOH溶液 B.H2O C.Na2SO3溶液 D.CCl4
所需的主要玻璃仪器是______________(填仪器名称)。要进一步制得纯净的C2H5Br,可用水洗,然后加入无水CaCl2,再进行_______________(填操作名称)。
(6)下列几项实验步骤,可用于检验溴乙烷中溴元素,其正确的操作顺序是:取少量溴乙烷,然后__________________(填代号)。
①加热;②加入AgNO3溶液;③加入稀HNO3酸化;④加入NaOH溶液;⑤冷却
25.在一定体积的密闭容器中,进行如下化学反应:
CO2(g)+H2(g) 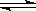 CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
|
t℃ |
700 |
800 |
830 |
1000 |
1200 |
|
K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K= 。
(2)该反应为 反应(选填吸热、放热)。
(3)能判断该反应是否达到化学平衡状态的依据是 (多选扣分)。
A.容器中压强不变 B.混合气体中c(CO)不变
C.v正(H2)=v逆(H2O) D.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为 ℃。
24.我国了“神舟”系列载人飞船的成功发射,标志着“炎黄子孙千年飞天梦想实现了”
(1)火箭升空时,由于与大气层的剧烈摩擦,产生高温。为了防止火箭温度过高,在火箭表面涂上一种特殊的涂料,该涂料的性质最可能的是 ( )
A.在高温下不融化 B.在高温下可分解气化
C.在常温下就分解气化 D.该涂料不可能发生分解
(2)火箭升空需要高能的燃料,经常是用N2O4和N2H4作为燃料,其反应的方程式是:N2O4 + N2H4 → N2 + H2O 。请配平该反应方程式:
----N2O4 + ----N2H4 → ----N2 + ----H2O
该反应中被氧化的原子与被还原的原子物质的量之比是 。这个反应应用于火箭推进器,除释放大量的热和快速产生大量气体外,还有一个很大的优点是 。
(3)为了向宇航员提供氧气,飞船上有专门的供氧装置。现有供氧剂过氧化钠与超氧化钾(KO2)。
①写出它们与二氧化碳反应的化学方程式(超氧化钾与二氧化碳的反应产物与过氧化钠类似):__________________ ____;_________________________。
②你选择的供氧剂是: ,原因是:____________________________。
23.第一电离能I1是指气态原子X(g)处于基态时,失去一个电子成为气态阳离子X+(g)所需的能量。下图是部分元素原子的第一电离能I1随原子序数变化的曲线图(其中12号至17号元素的有关数据缺失)。
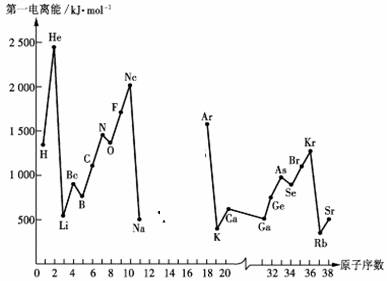
请回答以下问题:
(1)认真分析上图中同周期元素第一电离能的变化规律,推断Na--Ar元素中,Al的第一电离能的大小(最小)范围为 <Al< (填元素符号)。
(2)从上图分析可知,同一主族元素原子的第一电离能I1变化规律是______________;
(3)上图中第一电离能最小的元素在周期表中的位置是________________________;
(4)根据对角线规则,Be、Al元素最高氧化物水化物的性质相似,它们都具有 性,其中Be(OH)2显示这种性质的离子方程式是:__________ ___、____________________。
(5)单质C不可能具有的性质是
A.具有良好的导电性
B.熔沸点很高
C.硬度较小
D.易与Br单质反应,形成的化合物分子是极性分子。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com