
6.环境污染已成为人类社会面临的重大威胁,下列名词与环境污染有关的是:
①酸雨 ②臭氧空洞 ③“白色污染” ④温室效应 ⑤赤潮 ⑥光化学污染 ⑦噪声
A.①③④⑤ B.①②③④⑥⑦ C.③④⑤⑥⑦ D.①②③④⑤⑥⑦
29.(15分)存在于茶叶的有机物A,其分子中所含的苯环上有2个取代基,取代基不含支链,且苯环上的一氯代物只有2种。A遇FeCl3溶液发生显色反应。F分子中除了2个苯环外,还有一个六元环。它们的转化关系如下:
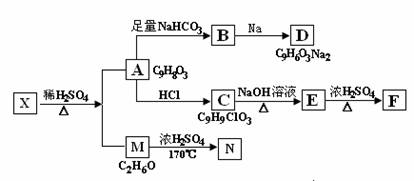
请回答下列问题:
(1)有机物A中含氧官能团的名称是 ;
(2)写出下列反应的化学方程式
A→B: ; M→N: ;
(3)A→C的反应类型为 ,E→F的反应类型为 ;
(4)1mol A可以和 mol Br2 反应;
(5)某营养物质的主要成分(分子式为C16H14O3)是由A和一种芳香醇R发生酯化反应生成的,则R的含有苯环的同分异构体有 种(不包括R);
(6)A→C的过程中还可能有另一种产物C1,请写出C1在NaOH水溶液中反应的化学方程式 。
28.(15分)为测定过氧化氢溶液的浓度,小明将一定量的过氧化氢溶液加入如图1的锥形瓶中,再加入少量二氧化锰,待反应完成后,称量锥形瓶和剩余物质的总质量。
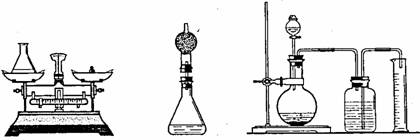
(图1) (图2) (图3)
小明进行了四次实验,结果如下表:
|
序号 |
锥形瓶质量(g) |
过氧化氢溶液体积(mL) |
二氧化锰质量(g) |
反应完成后锥形瓶和剩余物质总质量(g) |
|
1 |
80.0 |
100.0 |
1.6 |
180.2 |
|
2 |
80.0 |
100.0 |
1.6 |
179.8 |
|
3 |
80.0 |
100.0 |
1.6 |
180.0 |
|
4 |
80.0 |
100.0 |
1.6 |
182.6 |
请回答下列问题:(假设过氧化氢溶液的密度为1 g •cm-3,实验在标准状况下进行)
(1)写出上述反应的化学方程式 ;
(2)若以上表中的数据计算,该过氧化氢溶液的物质的量浓度是 ;
(3)若用图2装置代替图1中的锥形瓶进行实验,结果将更准确,其理由是 ;
(4)若用图3装置代替图2进行实验,结果将更加准确,其理由是 ;
(5)若过氧化氢溶液的浓度约为1mol •L-1,取20.0 mL该溶液按图3方案进行实验,则该实验应选用的量筒规格是( );
A.1000 mL B. 500 mL C. 250 mL D. 100 mL
(6)有人认为上述三个方案均不够好,可以采用滴定的方法进行测定,其反应原理为:
2KMnO4+5H2O2+3H2SO4==K2SO4+2MnSO4+5O2↑+8H2O
若过氧化氢溶液的浓度约为1mol •L-1,取10.0 mL,用0.5000 mol•L-1酸化的高锰酸钾溶液进行滴定。则:
①滴定时,盛装高锰酸钾溶液应选用 (填“酸式”或“碱式”)滴定管;
②判断到达滴定终点的现象是 ;
③实验时,需要记录的数据有 ;
④消耗的酸化高锰酸钾溶液的体积约为 mL。
27.(13分)已知甲、乙、丙、丁、戊为纯净物,它们之间有如下转化关系。请填空:
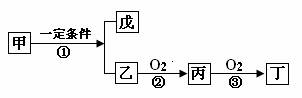
(1)若甲为天然气的主要成分,在高温条件下能实现上述转化。则反应①的化学方程式为: 。
(2)若甲为生活中常用的离子化合物,在熔融条件下电解能实现上述转化。则以惰性电极电解甲的水溶液时,阳极的电极反应式为: 。
(3)若甲为常见的离子化合物,可用作化肥,在加热条件下能实现上述转化。则反应②的化学反应方程式: 。实验室测定丁的相对分子质量时,得到的实验值总是比理论值大,其原因是 。
(4)若甲为制镜工业的常用物质,相对分子质量是甲醛的6倍,在催化条件下能实现上述转化。则反应③的化学反应方程式为: ;
26.(17分)短周期元素A、B、C、D在周期表中的位置如下图,回答下列问题:
|
A |
B |
C |
|
|
D |
|
(1)设A、B、C、D四种元素的原子序数之和为M,则M( );
A.必为奇数 B.必为偶数 C.可能为奇数,也可能为偶数
(2)若D元素原子的次外层电子数等于其它层电子数之和,则:
①A元素氢化物的电子式为 ,该分子属于 (填“极性”或“非极性”)分子;
②B元素的氢化物X与D元素的氧化物Y可反应生成一种强酸,则X、Y可能为:
和 ,或 和 (填分子式);
③A元素的氢化物与D元素最高价氧化物的水化物反应生成Z,则Z的水溶液中离子浓度由大到小的顺序为 ;
④用上述元素的氢化物、单质书写2个属于置换反应的化学方程式:
;
。
13.在密闭容器中,反应X2(g)+Y2(g) 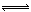 2XY(g);ΔH<0,达到甲平衡。在仅改变某一条件后,达到乙平衡,对此过程的分析正确的是 ( )
2XY(g);ΔH<0,达到甲平衡。在仅改变某一条件后,达到乙平衡,对此过程的分析正确的是 ( )
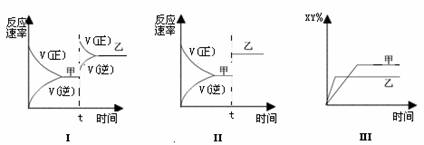
A.图Ⅰ是加入适当催化剂的变化情况
B.图Ⅱ是扩大容器体积的变化情况
C.图Ⅲ是增大压强的变化情况
D.图Ⅲ是升高温度的变化情况
第Ⅱ卷(非选择题 本卷10题 共 174 分)
12.一种合成染料的重要中间体-邻甲基水杨酸(M)的结构如图,其下列说法正确的是 ( )
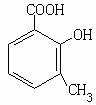
A.标准状况下,1 mol M与足量金属钠反应,能生成22.4 L氢气
B.1 mol M与足量碳酸钠反应,能生成6.02×1023个二氧化碳分子
C.1 mol M最多能与60 g甲醇发生酯化反应
D.1 mol M完全燃烧消耗8 mol氧气
11.为提纯下列物质(括号内的物质是杂质),所选用的除杂试剂和分离方法都正确的是 ( )
|
|
被提纯的物质 |
除杂试剂 |
分离方法 |
|
A |
溴化钠溶液(NaI) |
氯水、CCl4 |
萃取、分液 |
|
B |
氯化铵溶液(FeCl3) |
氢氧化钠溶液 |
过滤 |
|
C |
二氧化碳(CO) |
氧化铜粉末 |
通过灼热的CuO粉末 |
|
D |
乙酸乙酯(乙酸) |
乙醇、浓硫酸 |
加热 |
8.某溶液中由水电离出来的c(OH_)=10-12 mol·L-1,则该溶液中的溶质不可能是( )
A.NH3·H2O B.NaHCO3 C.NaOH D.CH3COOH
|
A.钢铁发生电化腐蚀的正极反应式为:Fe-3e-== Fe3+
B.甲醇碱性燃料电池的负极反应式为:O2 +2H2O +4e- == 4OH-
C.铁片镀铜时,铁片与电源正极相连
D.用惰性电极电解硫酸钠溶液,电解过程中溶液的pH保持不变
|
A.由二氧化碳是分子晶体,推测同族硅元素的同价氧化物也是分子晶体
B.由氢化物的稳定性H2O>NH3,推测氢化物的稳定性也是H2S>PH3
C.由甲酸可以发生银镜反应,推测羧酸均能发生银镜反应
D.由“2Fe+3Cl2=2FeCl3”反应,推测Fe和I2反应会生成FeI3
7. “神舟六号”的燃料是氢化锂三兄弟--LiH、LiD、LiT。其中Li的质量数为7,对这三种物质的下列说法正确的是 ( )
A.质子数之比为1:2:3 B.中子数之比为1:1:1
C.摩尔质量之比为8:9:10 D.化学性质不相同
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com