
6. 2008年北京奥运会“祥云”火炬用的是环保型燃料--丙烷(C3H8),悉尼奥运会火炬所用燃料为65%丁烷(C4H10)和35%丙烷,已知丙烷的燃烧热为:2221.5 kJ/mol,下列有关说法正确的是
A.奥运火炬燃烧主要是将化学能转变为热能和光能
B.丙烷的沸点比正丁烷高
C.丙烷、空气及铂片可组成燃料电池,在丙烷附近的铂极为电池的正极
D.丙烷燃烧的热化学方程式为:C3H8(g)+5O2(g)=3CO2(g)+4H2O(g);△H=-2221.5kJ/mol
5. 下列说法不正确的是( )
A.焓变是一个反应能否自发进行相关的因素,多数放热反应能自发进行
B.在同一条件下不同物质有不同的熵值,其体系的混乱程度越大,熵值越大
C.自发进行的反应一定能迅速进行
D.一个反应能否自发进行,与焓变和熵变的共同影响有关
4. 下列化学用语书写正确的是( )
A.氯化铵的电子式: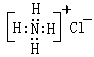 B.异丁烷的结构式:
B.异丁烷的结构式: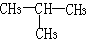
C.硫离子的最外层电子排布:3s23p4
D.氯化铯的晶体结构(晶胞)模型: 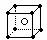
3. 5.6g铁粉投入到足量的100mL 2mol/L的稀硫酸的烧杯中,2 min时铁粉刚好溶解,下列表示这个反应的速率正确的是( )
A.v(Fe) = 0.5 mol/(L·min) B.v(H2SO4)= 1 mol/(L·min)
C.v(H2) = 0.5 mol/(L·min) D.v(FeSO4)= 0.5 mol/(L·min)
2. 意大利科学家使用氧分子和带正电的氧离子作用,合成出新型氧分子O4,它可能具有长方形结构,下列说法错误的是
A.O4与O2、O3都是氧的同素异形体
B.合成O4的反应可以看作核聚变反应
C.O4分子中存在非极性共价键
D.O4能量密度高,可用作更强力的火箭燃料氧化剂
1. 下列有关晶体的说法中正确的是 ( )
A.氯化钾溶于水时离子键未被破坏 B.原子晶体中共价键越强,熔点越高
C.冰融化时分子中共价键发生断裂 D.分子间作用力越大,分子越稳定
29.(16分)
A、B、C、D四种芳香族化合物都是某些植物挥发油中的主要成分,有的是药物,有的是香料。它们的结构简式如下所示:
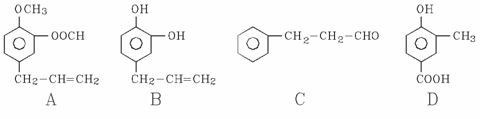
请回答下列问题:
(1)写出B中官能团的名称: ;1mol B能与含 摩尔Br2的溴水反应。
(2)用A、B、C、D填空:
①能发生银镜反应的有 。
②既能使FeCl3溶液显紫色又能和NaHCO3反应放出气体的有 。
(3)按下图C经一步反应可生成E,E是B的同分异构体,则反应①属于 反应(填反应类型名称),写出反应②的化学方程式: 。

(4)同时符合下列两项要求的D的同分异构体有4种
①化合物是1,2-二取代苯;
②苯环上的两个取代基分别为羟基和含有-COO-结构的基团
其中(G和H)结构简式如下图所示,请补充另外两种。
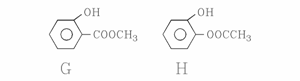
、 ,
写出H与足量NaOH溶液反应的化学方程式: 。
28.(15分)
实验室中,用如下图所示装置及所给药品(图中部分夹持仪器已略去)探究工业制硫酸接触室中的反应,并测定此条件下二氧化硫的转化率。已知SO3熔点为16.8℃,假设气体进入装置时分别被完全吸收,且忽略装置内空气中的CO2。
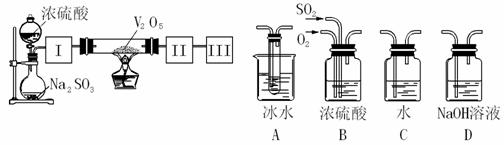
(1)已知0.5molSO2被O2氧化成气态SO3,放出49.15 kJ热量,反应的热化学方程式为 。
(2)根据实验目的,请从上面右图中选择Ⅰ、Ⅱ、Ⅲ处合适的装置,将其序号填入空格中:装置Ⅰ ,装置Ⅱ ,装置Ⅲ 。
(3)开始进行实验时,首先应进行的操作是 。
(4)加热硬质玻璃管时,若不断升高温度,SO2的转化率会 (填“增大”、“不变”或“减小”)。
(5)停止通入SO2,熄灭酒精灯后,为使残留在装置中的SO2、SO3被充分吸收,操作方法是 。
(6)实验结束后,若装置Ⅱ增加的质量为b g ,装置Ⅲ增加的质量为a g,则此条件下二氧化硫的转化率是 (用含字母的代数表示)。
27.(15分)
A、B、C、D、E、F六种物质的相互转化关系如下图所示(反应条件及部分产物未列出)。
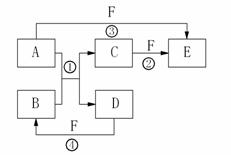
(1)若A是常见金属单质,与B的水溶液反应生成C和D。D、F是气体单质,D在F中燃烧时发出苍白色火焰。则F所对应的元素在周期表位置是 ;反应②(在水溶液中进行)的离子方程式为 。
(2)若A、D为短周期元素组成的固体单质,一种为金属,另一种为非金属。且③④两个反应都有红棕色气体生成,则反应①、④的化学方程式分别为
① ;
④ 。
(3)若A、D、F都是短周期非金属单质,且A、D所含元素同主族,A、F所含元素同周期,C是一种能与血红蛋白结合的有毒气体;则物质B的晶体类型是
,分子E的结构式是 。
26.(14分)
A、B、C、D、E是核电荷数依次增大的5种短周期主族元素;原子半径按D、E、B、C、A顺序依次减小,B和E是同主族元素。
(1)下列推断正确的是 。
a.A、B、E不可能在同一主族 b.A、B、C可能在同一周期
c.C的最高价氧化物的水化物可能显碱性 d.C和D的单质可能生成离子化合物
(2)若A与D同主族,B是形成化合物种类最多的元素,C原子的最外层电子数比A与B的最外层电子数总和还多1。则A与C元素按原子个数比2:1形成的化合物F的电子式为 ;C与D形成的原子个数比1: 1的化合物与F反应的化学方程式为 ;由A、B、C、D四元素按原子个数比1:1:3:1形成的化合物水溶液呈 性(填“酸”或“碱”),原因是 (用离子方程式表示)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com