
30.(14分)某化学探究学习小组拟利用下列装置测定某黑色铁的氧化物矿样的化学式(设矿样不含其它杂质)。主要化学反应为:
①H2C2O4(乙二酸)CO2↑+CO↑+H2O ②Fe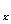 O
O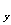 +
+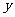 CO=
CO=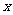 Fe+
Fe+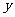 CO2
CO2
他们要测定的数据是矿样质量和反应②所生成的CO2的质量[用m(Fe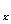 O
O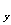 )和m(CO2)表示]。所需仪器(连同药品)的示意图如下(必要时有的仪器可重复使用)
)和m(CO2)表示]。所需仪器(连同药品)的示意图如下(必要时有的仪器可重复使用)
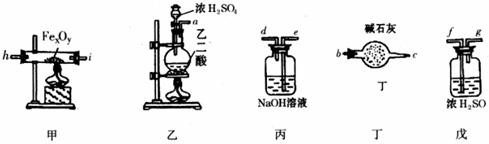
(1)假设洗气(或吸气)装置丙、丁、戊内的反应进行得都完全,按气体从左至右的流向将上述仪器组装起来(用接口字母a、b……表示):
接 , 接 , 接 , 接 , c 接 f
(2)实验中有一件仪器前后用到两次,前边用它的目的是 ,后边又用它的目的是 。
(3)为了保护环境,怎样处理仪器末端导出的CO(写出具体方法)
(4)该小组测得m(Fe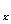 O
O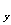 )=15.2g,m(CO2)=11.0g,则x:y为
)=15.2g,m(CO2)=11.0g,则x:y为
A.4:5 B.1:1 C.2:3 D.3:4
在该实验中,反应前Fe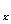 O
O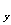 为黑色,反应后生成的Fe也为黑色,难以确定Fe
为黑色,反应后生成的Fe也为黑色,难以确定Fe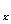 O
O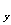 是否完全被还原,若仍有Fe
是否完全被还原,若仍有Fe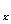 O
O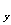 剩余,则所测的x:y值比实际值 (填偏低,偏高或不影响)采取什么措施可以避免上述原因引起的偶然误差:
剩余,则所测的x:y值比实际值 (填偏低,偏高或不影响)采取什么措施可以避免上述原因引起的偶然误差:
(5)仍用上述提供的仪器和药品(必要时可以少选用也可以按新的顺序进行组装),同样测定两种物质的质量,便可计算出x和y的比值,写出要测定的两种数据可能的组合:
① ② ③
(若不够三种组合,可不必填满;若多于三种组合,可自行增加)
[选做部分]
考生从中选择1个化学题作答。
29.(12分)我国有较长的海岸线,海洋资源十分丰富。利用海水资源可以发展很多种工业,下图中包含了中学课本中介绍的几种基本工业生产,请根据各物质之间的转化关系回答下列问题:
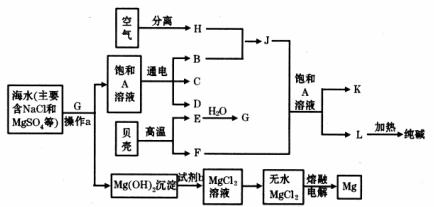
(1)从海水中提取镁的步骤中,试剂b可以选用上图中的 发生反应制取得到(以字母表示)。
(2)分离出Mg(OH)2后的溶液中除NaCl外,还含有CaCl2、Na2SO4等杂质,为了获得纯净的溶液A,在分离后的溶液中应依次加人过量的BaCl2溶液、Na2CO3溶液并过滤,再向滤液中加入适量盐酸。实验中加人过量BaCl2溶液是为了除去 离子;加入过量Na2CO3溶液发生反应的离子方程式是 。
(3)C和D、C和G反应都可以制取消毒剂。C和G反应制取的消毒剂中有效成分的化学式为 。
(4)电解A溶液时阳极反应的电极反应式为 ,当阴极产生标准状况下的气体1.12L时,整个过程中转移的电子总数为 (阿伏加德罗常数用NA表示)。
(5)将F和J通入A的饱和溶液中,反应的化学方程式为 。
(6)为了从海带中提取碘,某研究性学习小组设计并进行了以下实验:
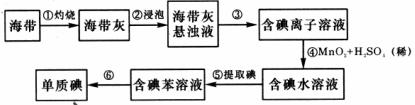
步骤⑤所选用主要仪器是 ,步骤⑥的目的是从含碘苯溶液中分离出单质碘和回收苯,该步骤的实验操作名称是 。
28.(16分)化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理。请回答下列问题:
(1)对于可逆反应mA(g)+nB(g)
 pC(g)+qD(g)达平衡时,V正=k1c(A)mc(B)n(K1为速率常数),达平衡时化学平衡常数为K2,且K1、K2只与温度有关。现将4molSO2与2molO2充入体积为2L的密闭容器中,500℃进行反应并保持温度不变,反应达到平衡时,SO2的转化率为50%。则起始时正反应速率是平衡时的
倍。500℃时,该反应的平衡常数K2是
。在温度不变时,再向平衡体系中加人2molSO2、2molO2与4molSO3,平衡将向
移动。
pC(g)+qD(g)达平衡时,V正=k1c(A)mc(B)n(K1为速率常数),达平衡时化学平衡常数为K2,且K1、K2只与温度有关。现将4molSO2与2molO2充入体积为2L的密闭容器中,500℃进行反应并保持温度不变,反应达到平衡时,SO2的转化率为50%。则起始时正反应速率是平衡时的
倍。500℃时,该反应的平衡常数K2是
。在温度不变时,再向平衡体系中加人2molSO2、2molO2与4molSO3,平衡将向
移动。
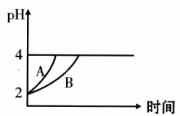
(2)常温下,取pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如下图所示。则图中表示醋酸溶液中pH变化曲线的是 (填“A”或“B”)。
设盐酸中加入的Zn质量为m1,醋酸溶液中加入的Zn质量为m2。则m1 m2(选填“<”、“=”,“>”)。
(3)难溶电解质在水溶液中存在着电离平衡。在常温下,溶液里各离子浓度以它们化学计量数为方次的乘积是一个常数,叫溶度积常数(KSP)。当溶液中各离子浓度方次的乘积大于溶度积时,则产生沉淀,反之固体溶解。已知常温下Cu(OH)2的溶度积为2×10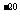 ,若某CuSO4溶液里,c(Cu2+)=0.02mol/L,如果生成Cu(OH)2沉淀,应调整溶液pH,使之大于 ;要使0.2mol/L的CuSO4溶液中Cu2+沉淀较为完全(使Cu2+浓度降至原来的千分之一)则应向溶液里加NaOH溶液,使溶液pH值为
。
,若某CuSO4溶液里,c(Cu2+)=0.02mol/L,如果生成Cu(OH)2沉淀,应调整溶液pH,使之大于 ;要使0.2mol/L的CuSO4溶液中Cu2+沉淀较为完全(使Cu2+浓度降至原来的千分之一)则应向溶液里加NaOH溶液,使溶液pH值为
。
(4)常温下,某纯碱(Na2CO4)溶液中滴入酚酞,溶液呈红色。则该溶液呈
性。在分析该溶液遇酚酞呈红色原因时,甲同学认为是配制溶液所用的纯碱样品中混有NaOH所至;乙同学认为是溶液中Na2CO3电离出的CO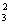 水解所至。请你设计一个简单的实验方案给甲和乙两位同学的说法以评判(包括操作、现象和结论)
。
水解所至。请你设计一个简单的实验方案给甲和乙两位同学的说法以评判(包括操作、现象和结论)
。
15.向一定量的Fe、FeO和Fe2O3的混合物中加入l20rnL 4 mol/L的稀硝酸,恰好使混合物完全溶解,放出1.344L NO(标准状况),往所得溶液中加入KSCN溶液,无血红色出现。若用足量的氢气在加热下还原相同质量的混合物,能得到铁的物质的量为
A.0.24mol B.0.21mol C.0.16mol D.0.14mol
第Ⅱ卷 (必做120分+选做32分,共152分)
[必做部分]
14.常温下,下列各溶液的叙述中正确的是
A.0.1 mol/L的醋酸钠溶液20mL与0.1 mol/L盐酸10 mL混合后溶液显酸性
c(Ac一)>c(Cl一)>c(H+)>c(HAc)
B.pH>7的醋酸钠和醋酸混合液中:c(Na+)=c(CH3COO一)
C.0.1mol/L的醋酸的7pH=a,0.01mol/L的醋酸的pH=b,则a+1>b
D.已知酸性HF>CH3COOH,pH相等的NaF与CH3COOK溶液中,
[c(Na+)一c(F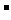 )]<[c(K+)一c(CH3COO一)]
)]<[c(K+)一c(CH3COO一)]
13.下列反应对应的离子方程式中正确的是
A.铜与浓硝酸混合Cu+4HNO3(浓)=Cu2++2NO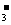 +2NO2↑+2H2O
+2NO2↑+2H2O
B.用惰性电极电解MgCl2溶液:2Cl一+2H2O Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
C.NaHSO4溶液与Ba(OH)2溶液混合呈中性:
2HSO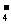 +Ba2++2OH一==BaSO4↓+SO
+Ba2++2OH一==BaSO4↓+SO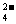 +2H2O
+2H2O
D.氢氧化铜溶于氢溴酸Cu(OH)2+2H+=Cu2++2H2O
12.用下列实验装置进行的实验中,能达到相应实验目的的是
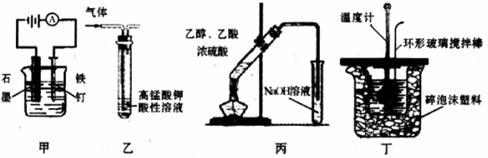
A.装置甲:防止铁钉生锈 B.装置乙:除去乙烷中混有的乙烯、乙炔
C.装置丙:实验室制取乙酸乙酯 D.装置丁:中和反应反应热的测定
11.元素A和元素B的原子序数都小于18,已知A原子的最外层电子数为a,次外层电子数为b,B原子的M层电子数为(a-b),L层电子数为(a+b),则下列叙述不正确的是
A.B元素位于周期表中的第三周期、第ⅣA族
B.A、B两元素原子通过共价键形成的化合物BA2
C.A、B两元素所形成的化合物能与碳反应
D.A、B两元素所形成的化合物既能与氢氧化钠溶液反应又能与盐酸反应
10.若两物质恰好完全发生化学反应,下列各项中,反应前后一定不发生变化的是
①电子总数 ②原子总数 ③分子总数 ④物质的种类 ⑤物质的总质量
A.④⑤ B.②⑤ C.①②⑤ D.①②③⑤
9.某溶液中只可能含有下列离子中的几种:K+、NO3 、SO
、SO 、NH4+、CO
、NH4+、CO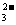 (不考虑少量的H+与OH一),取200mL该溶液分成两等份,进行以下实验。
(不考虑少量的H+与OH一),取200mL该溶液分成两等份,进行以下实验。
(1)第一份加入足量的烧碱并加热,产生的气体在标准状况下为224mL
(2)第二份先加足量的盐酸无现象,再加足量的BaCl2i溶液,得到2.33g固体,则该溶液中
A.可能含有K+ B.肯定含有NO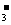 、SO
、SO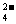 、NH
、NH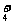 、CO
、CO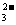
C.一定不含有NO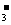 D.一定含有K+且c(K+)≥0.1mol·L
D.一定含有K+且c(K+)≥0.1mol·L
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com