
6.下列离子方程式正确的是
A.用惰性电极电解饱和氯化钠溶液:2Cl- +
2H+  H2↑+ Cl2↑
H2↑+ Cl2↑
B.用银氨溶液检验乙醛中的醛基:
CH3CHO +2Ag(NH3)2+ + 2OH- CH3COO- + NH4+
+3NH3 + 3Ag↓+ H2O
CH3COO- + NH4+
+3NH3 + 3Ag↓+ H2O
C.苯酚钠溶液中通入少量CO2:CO2 + H2O + 2C6H5O- 2C6H5OH
+ 2CO32-
2C6H5OH
+ 2CO32-
D.Na2SO3溶液使酸性KMnO4溶液褪色:5SO32- + 6H+ + 2MnO4-=5SO42- + 2Mn2+ + 3H2O
5.在下列溶液中,各组离子一定能够大量共存的是
A.使酚酞试液变红的溶液: Na+、Cl-、SO42-、Fe3+
B.使紫色石蕊试液变红的溶液:Fe2+、Mg2+、NO3-、Cl-
C.c(H+)=10-12 mol·L-1的溶液:K+、Ba2+、Cl-、Br-
D.碳酸氢钠溶液:K+、SO42-、Cl-、H+
4.某有机物小分子含有C、H、O、N等元素,该有机物可能是
A.脂肪 B.葡萄糖 C.蛋白质 D.氨基酸
3.下列叙述正确的是
A.直径介于1nm-100nm之间的微粒称为胶体
B.电泳现象可证明胶体属电解质溶液
C.利用丁达尔效应可以区别溶液与胶体
D.胶体粒子很小,可以透过半透膜
2.下列实验方法合理的是
A.可用水鉴别己烷、四氯化碳、乙醇三种无色液体
B.油脂皂化后可用渗析的方法使高级脂肪酸钠和甘油充分分离
C.可用澄清石灰水鉴别Na2CO3溶液和NaHCO3溶液
D.为准确测定盐酸与NaOH溶液反应的中和热,所用酸和碱的物质的量应相等
1.下列说法正确的是
A.乙醇和汽油都是可再生能源,应大力推广“乙醇汽油”
B.钢铁在海水中比在河水中更易腐蚀,主要原因是海水含氧量高于河水
C.废弃的塑料、金属、纸制品及玻璃都是可回收再利用的资源
D.凡含有食品添加剂的食物对人体健康均有害,不宜食用
26.蛋白质在一定条件下与浓硫酸反应可转化为硫酸铵,后者在浓氢氧化钠溶液和水蒸气作用下,其中的氮元素可转化为氨析出。现用30.0 ml牛奶进行上述实验,将牛奶中蛋白质里的氮元素完全转化成氨,再用50.0 ml 0.500 mol·L-1硫酸溶液吸收析出的氨,剩余的酸用38.0 ml 1.00 mol·L-1 氢氧化钠溶液可恰好完全中和。问:
(1) 30.0 ml 牛奶中共含有多少克氮? ( 已知牛奶的密度是 1.03 g·ml-1 )
(2) 如果蛋白质中含氮16%(质量分数),则牛奶中蛋白质的质量分数是多少?
25.(6分) (1)相对分子质量为58的烷烃的分子式是_______________,
(2)它可能的结构简式是_______
24.(20分) “酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如下图所示的装置制取乙酸乙酯。回答下列问题:
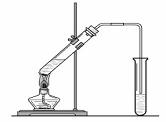
(1)写出制取乙酸乙酯的化学反应方程式
(2)在大试管中配制一定比例的乙醇、乙酸和浓硫酸的混合液的方法是: 。
(3)浓硫酸的作用是:① ;② 。
(4)饱和碳酸钠溶液的主要作用是 。
(5)装置中通蒸气的导管要插在饱和碳酸钠溶液的液面上,不能插入溶液中,目的是防止 。
(6)若要把制得的乙酸乙酯分离出来,应采用的实验操作的名称是 。
(7)做此实验时,有时还向盛乙酸和乙醇的试管里加入几块碎瓷片,其目的是 。
(8)生成乙酸乙酯的反应是可逆反应,反应物不能完全变成生成物,反应一段时间后,就达到了该反应的限度,也即达到化学平衡状态。下列描述能说明乙醇与乙酸的酯化反应已达到化学平衡状态的有(填序号) 。
①单位时间里,生成1mol乙酸乙酯,同时生成1mol水
②单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸
③单位时间里,消耗1mol乙醇,同时消耗1mol乙酸
④正反应的速率与逆反应的速率相等
⑤混合物中各物质的浓度不再变化
23.(8分)中国在新工业化发展过程中,开发可再生能源以缓解石油短缺引起的能源危机是一个重要的课题。2003年元月份,辽宁省投资建设一个年生产工业酒精500万吨的工厂,目的是为了将工业酒精与汽油混合作为汽车燃料而减少汽油的消耗量。已知制酒精的方法有三种:
方法一:在催化剂作用下乙烯与水反应
方法二:CH3-CH2Br + H2O 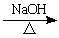 CH3CH2OH
+ HBr
CH3CH2OH
+ HBr
方法三:(C6H10O5)n(淀粉)+ n H2O  n C6H12O6(葡萄糖)
n C6H12O6(葡萄糖)
C6H12O6(葡萄糖)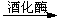 2C2H5OH + 2CO2↑
2C2H5OH + 2CO2↑
(1) 你认为应用哪一种方法生产工业酒精能够缓解石油短缺带来的能源危机?为什么? (2)方法一的化学反应方程式是: ,
(3) 乙醇燃烧的化学方程式是:
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com