
6.下列溶液一定是碱性的是
A.溶液中c(OH-)>c(H+). B.滴加甲基橙后溶液显红色.
C.溶液中含有OH--. D.滴加甲基橙后溶液显黄色.
5.将等物质的量的Mg和Al混合均匀,分成四等份,分别加到下列四种过量的溶液中,充分反应后,放出H2最多的是
A.3mol/LHCl溶液 B.4mol/LHNO3溶液
C.8mol/LNaOH溶液 D.18mol/LH2SO4溶液
4.在含有酚酞的0.1mol/L氨水中加入少量的NH4Cl晶体,则溶液的颜色
A.变蓝色 B.变深 C.变浅 D.不变
3.下列电离方程式中,正确的是
A.HClO4 == H++ClO4- B.H2CO3 2H++CO32-
2H++CO32-
C.H2PO4-+H2O== HPO42-+H3O+ D.NH3·H2O == NH4++OH-
2.能区别氯化镁、氯化铝、硫酸铵、硫酸钾的一种试剂是
A.硝酸银 B.氯化钡 C.氢氧化钠 D.浓氨水
1.将游离态的氮转化为化合态的氮的方法叫氮的固定。下列反应起氮的固定作用的是
A.N2与H2反应合成NH3 B.NH3经催化氧化生成NO
C.NO与O2反应生成NO2 D.由NH3制碳铵和硫铵
25、(6分)10mL某气态烃,在50mL氧气中充分燃烧,得到液态水和35mL气体(气体体积均在同温同压下测定)此烃可能是
24、(15分)卤块的主要成分是MgCl2,此外还含Fe3+、Fe2+和Mn2+等离子。若以它为原料按下图所示工艺流程进行生产,可制得轻质氧化镁。
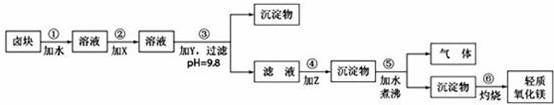
若要求产品尽量不含杂质,而且生产成本较低,根据表1和表2提供的资料,填写空白:
表1生成氢氧化物沉淀的pH
|
物质 |
开始沉淀 |
沉淀完全 |
|
Fe(OH)3 |
2.7 |
3.7 |
|
Fe(OH)2 |
7.6 |
9.6* |
|
Mn(OH)2 |
8.3 |
9.8 |
|
Mg(OH) 2 |
9.6 |
11.1 |
Fe2+氢氧化物呈絮状,不易从溶液中除去,常将它氧化为Fe3+,生成Fe(OH)3沉淀除去。
表2原料价格表
|
物质 |
价格/元·吨-1 |
|
漂液(含25.2%NaClO) |
450 |
|
双氧水(含30%H2O2) |
2400 |
|
烧碱(含98%NaOH) |
2100 |
|
纯碱(含99.5%Na2CO3) |
600 |
(1)在步骤②中加入的试剂X,最佳的选择是 ,其作用是 ;
(2)在步骤③中加入的试剂应是 ;之所以要控制pH=9.8,其目的是 ;
(3)在步骤④中加入的试剂Z应是 ;
(4)在步骤⑤中发生的反应是 。
23、(10分)X、Y、Z为三种不同短周期非金属元素的单质。在一定条件下发生如下反应:
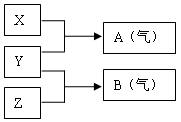
请针对以下两种不同的情况回答:
(1)若常温下X、Y、Z均为气体,且A和B在化合生成固体C时有白烟产生,则:
①Y的化学式是 ;
②生成固体C的化学方程式是 。
(2)若常温下Y为固体,X、Z为气体,A在空气中充分燃烧可生成B,则:
①B的化学式为 ;
②向苛性钠溶液中通入过量的A所发生反应的离子方程式为 ;
③将B与(1)中某单质的水溶液充分反应可生成两种强酸,该反应的化学方程式为
。
21、(4分)将11.2L(标准状况)乙烯和乙烷的混合气体,通入足量溴的四氯化碳溶液中,充分反应后,溴的四氯化碳溶液质量增加了5.6g。
求:原混合气体中乙烯和乙烷的物质的量之比为 质量之比为
22(6分)、铅蓄电池是广泛应用于汽车、柴油机车等的起动电源。产生电能时的电极反应分别为:
Pb+ SO42--2e-= PbSO4
PbO2+4H++SO42-+2e-= PbSO4+2H2O
(1)试写出铅蓄电池放电时的总反应式(电池反应):
(2)铅蓄电池的电解质溶液是 ,在放电过程中,它的浓度的变化趋势是 ,
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com