
26. (15分)a、b、c、d、e是短周期元素,周期表中a与b、b与c相邻;a与e的最外层电子数之比为2:3,b的最外层电子数比e的最外层电子数少1个;常见化合物d2c2与水反应生成c的单质,且溶液使酚酞试液变红。
(1)e的元素符号是__________。
(2)a、b、c的氢化物稳定性顺序为(用分子式表示)__________________;b的氢化物和b的最高价氧化物的水化物反应生成Z,则Z中的化学键类型为__________________,Z的晶体类型为_____________;ab-离子的电子式为____________。
(3)由a、c、d形成化合物的水溶液显碱性,其原因是(用离子方程式表示)_____________________________________。
(4)一定量的d2c2与ac2反应后的固体物质,恰好与0.8 mol稀盐酸溶液完全反应,并收集到0.25 mol气体,则用物质的量表示该固体物质的组成为__________________、___________________。
13.“诺龙”属于国际奥委会明确规定的违禁药品中合成代谢类的类固醇,其结构简式如图所示。下列关于“诺龙”的说法中不正确的是
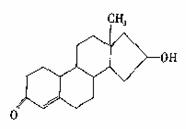
A.分子式是C18H26O2
B.能在NaOH醇溶液中发生消去反应
C.既能发生加成反应,也能发生酯化反应
D.既能发生氧化反应,也能发生还原反应
第Ⅱ卷(共10题,共174分)
12.下列反应的离子方程式正确的是
A.氢氧化钠溶液中通入少量二氧化硫:SO2+OH- = HSO3-
B.碳酸氢钠溶液与足量氢氧化钡溶液混合:HCO3- +Ba2++OH- = BaCO3↓+H2O
C.盐酸滴入氨水中:H++OH- = H2O
D.碳酸钙溶解于稀硝酸中:CO32 -+2H+ = CO2↑+H2O
11.某学生设计了一个“黑笔写红字”的趣味实验。滤纸先用氯化钠、无色酚酞的混合液浸湿,然后平铺在一块铂片上,接通电源后,用铅笔在滤纸上写字,会出现红色字迹。据此,下列叙述正确的是

A.铅笔端作阳极,发生还原反应
B.铂片端作阴极,发生氧化反应
C.a点是负极,b点是正极
D.铅笔端有少量的氯气产生
10. 2007年10月10日,德国科学家格哈德·埃尔特生日当天获得了诺贝尔化学奖,以奖励他在表面化学领域做出开拓性的贡献。格哈德研究了氨的合成与催化剂面积大小关系,对于提高合成氨的经济效益意义重大。N2+3H2
 2NH3; △H<0 。下列有关说法正确的是
2NH3; △H<0 。下列有关说法正确的是
A.增大催化剂的表面积,能提高氮气转化率
B.增大催化剂的表面积,能同时、同等程度的增大正逆反应速率
C.工业合成氨采用高压,且压强越高越有利于提高经济效益
D.单位时间内,当断裂3molH-H键和生成6molN-H键时达到化学平衡
9.莫尔盐[(NH4)2Fe(SO4)2·6H2O]常作氧化还原滴定法的基准物质,在0.1mol/L的该盐的溶液中,下列有关比较不正确的是
A.c(SO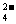 )> c(NH
)> c(NH )>c(Fe2+)>c(H+)>c(OH-)
)>c(Fe2+)>c(H+)>c(OH-)
B.c(NH3·H2O)+c(NH )= 0.2mol/L
)= 0.2mol/L
C.2c(SO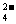 )+ c(OH-)=
c(NH
)+ c(OH-)=
c(NH )+2 c(Fe2+)+c(H+)
)+2 c(Fe2+)+c(H+)
D.c(H+)= c(OH-)+c(NH3·H2O)
8.设NA为阿伏加德罗常数,下列叙述中正确的是
A.常温下11.2 L的甲烷气体含有甲烷分子数为0.5 NA个
B.0.1 mol/L的氢氧化钠溶液中含钠离子数为0.1 NA个
C.14 g乙烯和丙烯的混合物中总原子数为3 NA个
D.5.6 g铁与足量的稀硫酸反应失去电子数为0.3 NA个
7.短周期元素X、Y、Z的原子序数依次递增,其原子的最外层电子数之和为13。X与Y、Z位于相邻周期,Z原子最外层电子数是X原子内层电子数的3倍或者是Y原子最外层电子数的3倍。下列说法正确的是
A.Y的氧化物是离子化合物
B.X的氢化物溶于水显酸性
C.Z的氢化物的水溶液在空气中存放不易变质
D.X和Z的最高价氧化物对应的水化物都是弱酸
6. 在一定条件下,分别以高锰酸钾、氯酸钾、过氧化氢(H2O2)为原料制取氧气,当制得同温、同压下相同体积的O2时,三个反应中转移的电子数之比为
A.1∶1∶1 B.2∶2∶1
C.2∶3∶1 D.4∶3∶2
22.(8分)氢化亚铜(CuH)是一种难溶物质,不稳定;60℃时可在空气中自燃;与稀盐酸
反应能生成气体,Cu+在酸性条件下发生如下反应 2Cu+ = Cu2+ + Cu。
根据以上信息,结合自己所掌握的化学知识,回答下列问题:
(1)在40℃~50℃时,用CuSO4溶液和“另一物质”可制得CuH,用氧化还原观点分析,
这“另一物质”在反应中所起的作用是 (填“氧化剂”或“还原剂”);
(2)60℃时CuH在空气中自燃的化学反应方程式为 ;
(3)CuH溶解在稀盐酸中的反应方程式为 ;
(4)如果把CuH溶解在足量的稀硝酸中反应,则CuH中的两种元素在生成物中分别存在于 物质中(填化学式)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com