
20. (13分)实验室用密度为1.18g/mL,质量分数为36.5%浓盐酸配制250mL0.1mol/L的盐酸溶液,填空并请回答下列问题:
(1)配制250mL0.1mol/L的盐酸溶液
|
应量取的盐酸体积/mL |
应选用容量瓶的规格/mL |
除容量瓶外还需要的其它仪器 |
|
|
|
|
(2)配制时,其正确的操作顺序是(字母表示,每个字母只能用一次) ___ _____。
A.用30mL水洗涤烧杯2-3次,洗涤液均注入容量瓶,振荡
B.用量筒量取准确量所需的浓盐酸的体积,沿玻璃棒倒入烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入250mL的容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度2-3cm处
(3)操作A中,将洗涤液都移入容量瓶,其目的是 。
溶液注入容量瓶前需恢复到室温,这是因为___________________ ____________。
(4)若出现如下情况,对所配溶液浓度将有何影响?(填偏高,偏低或无影响)没有进行A操作 ;加蒸馏水时不慎超过了刻度 ;定容时俯视_________________________.
(5)若实验过程中出现如下情况如何处理?加蒸馏水时不慎超过了刻度 ;向容量瓶中转移溶液时(实验步骤②)不慎有液滴掉在容量瓶外面 。
19.(10分)下列图示中,A为一种常见的单质,B、C、D、E是含A元素的常见化合物,它们的焰色反应均为黄色。
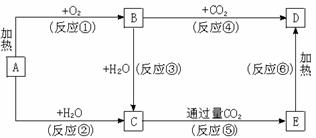
请填写下列空白:
(1)写出化学式:A________________,B________________,D________________。
(2)以上反应中,属于氧化还原反应的有____________________(填写编号)。
(3)写出E→D的化学方程式 。
18.(9分)Cl2 和NH3 能发生下列反应:3Cl2+8NH3==6NH4Cl+N2 。
(1)该反应中氧化剂是 ,还原剂是 。被氧化的NH3 占参加反应的NH3的 ;氧化剂与作还原剂物质的分子个数比为 。
(2)若有6.8g NH3 参加了反应,则被氧化的NH3 为 g,生成氧化产物 g。
17.足量铜与一定量浓硝酸反应得到硝酸铜溶液和NO2、N2O4、NO 的混合气体,这些气体与1.68LO2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入5mol/LNaOH溶液至Cu2+ 恰好完全沉淀,则消耗NaOH溶液的体积是
A.60mL B.45mL C.30mL D.15mL.
第II卷(非选择题共49分)
16.在NaCl、MgCl2、MgSO4形成的混合溶液中,c(Na+)=0.1mol/L,c(Mg2+)=0.25mol/L
c(Cl-)=0.2mol/L,则c(SO42-)为
A.0.15 mol/L B. 0.10 mol/L C.0.25 mol/L D. 0.20 mol/L
15. 配制1mol·L-1NaOH溶液,下列操作会导致所配溶液浓度偏高的是
A. 称量时,左盘高,右盘低
B. 原容量瓶洗净后未干燥
C. 在烧杯预溶后立即将溶液转移到容量瓶内
D. 定容时仰视读取刻度
14. 已知常温下氯酸钾与浓盐酸反应放出氯气,现按下图进行卤素的性质实验。玻璃管内装有分别滴有不同溶液的白色棉球,反应一段时间后,对图中指定部位颜色描述正确的是

|
|
① |
② |
③ |
④ |
|
A |
黄绿色 |
橙色 |
蓝色 |
白色 |
|
B |
无色 |
橙色 |
紫色 |
白色 |
|
C |
黄绿色 |
橙色 |
蓝色 |
无色 |
|
D |
黄绿色 |
无色 |
紫色 |
白色 |
13.已知Q与R的摩尔质量之比为9:22。在反应X + 2Y = 2Q + R中,当1.6gX与Y完全反应后, 生成4.4gR,则参与反应的Y和生成物Q的质量比为
A.46:9 B.32:9 C.23:9 D.16:9
12.下列反应的离子方程式书写正确的是
A.NaHSO4溶液中加Ba(OH)2溶液至中性: Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O
B.碳酸氢钙溶液中加入足量烧碱溶液:HCO3-+OH-=CO32-+H2O
C.金属钠溶于足量水中:Na+2H2O=Na++H2↑+2OH-
D.AlCl3溶液中滴加浓氨水至过量:Al3++4NH3·H2O=AlO2-+4NH4++2H2O
11. 在一定条件下,1体积气体A2和3体积气体B2完全反应生成了2体积气体X(体积在相同条件下测定),则X的化学式是
A. AB B. A2B3 C. AB2 D. AB3
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com