
18.(10分)“氢能”将是未来最理想的新能源。
(1)实验测得,1g氢气燃烧生成液态水时放出142.9kJ热量,则氢气燃烧的热化学方程式为___________________________。(填序号)
A.2H2(g)+O2(g)
 2H2O(l);△H=-142.9kJ·mol-1
2H2O(l);△H=-142.9kJ·mol-1
B.H2(g)+ O2(g)
O2(g)  H2O(l);△H=-285.8kJ·mol-1
H2O(l);△H=-285.8kJ·mol-1
C.2H2+O2 2H2O(l);△H=-571.6kJ·mol-1
2H2O(l);△H=-571.6kJ·mol-1
D.H2(g)+ O2(g)
O2(g)  H2O(g);△H=-285.8kJ·mol-1
H2O(g);△H=-285.8kJ·mol-1
(2)某化学家根据“原子经济”的思想,设计了如下制备H2的反应步骤
①CaBr2+H2O CaO+2HBr ②2HBr+Hg
CaO+2HBr ②2HBr+Hg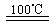 HgBr2+H2
HgBr2+H2
③HgBr2+_____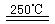 _____ ④2HgO
_____ ④2HgO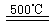 2Hg+O2↑
2Hg+O2↑
⑤2H2 +O2 2H2O
2H2O
请你根据“原子经济”的思想完成上述步骤③的化学方程式:________________________。并根据“绿色化学”的思想评估该方法制H2的主要缺点:__________________________。
(3)利用核能把水分解制氢气,是目前正在研究的课题。下图是其中的一种流程,其中用了过量的碘。
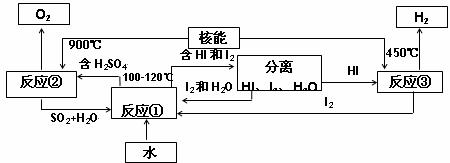
完成下列反应的化学方程式:反应①______________;反应②________________________。此法制取氢气的最大优点是_____________________________。
(4)目前有科学家在一定条件下利用水煤气(CO+H2)合成甲醇:
CO(g)+2H2(g) CH3OH(g)。甲醇的物质的量与反应温度的关系如下图所示:
CH3OH(g)。甲醇的物质的量与反应温度的关系如下图所示:
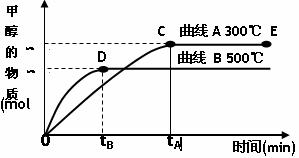
①合成甲醇反应,其反应热△H______0。(填“>”、“<”或“=”)
②其它条件不变,对处于E点的体系体积压缩到原来的1/2,正反应速率加快,逆反应速率_________。(填“加快”、“减慢”、“不变”)重新平衡时c(CH3OH)/c(CO)_________。(填“增大”、“减小”或“不变”)
③据研究,合成甲醇反应体系中通入少量CO2有利于维持催化剂Cu2O的量不变,原因是(用化学方程式表示)_______________________________________。
17.(10分)工业生产硝酸铵的流程图如下图。请回答:
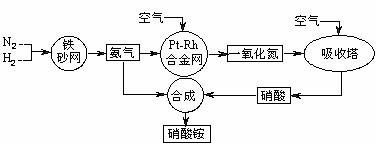
(1)已知 :N2(g)+3H2(g) 2NH3(g) ΔH=-92 kJ·mol-1。
2NH3(g) ΔH=-92 kJ·mol-1。
①在500℃、2.02×107Pa和铁催化条件下向一密闭容器中充入1molN2和3molH2,充分反应后,放出的热量______(填“<”“>”“=”)92.4kJ,理由是________ _________。
②为有效提高氢气的转化率,实际生产中宜采取的措施有____________
A.降低温度 B.最适合催化剂活性的适当高温 C.增大压强
D.降低压强 E.循环利用和不断补充氮气 F.及时移出氨
(2) 已知铂铑合金网未预热也会发热。写出氨催化氧化的化学方程式:_____________________________________________ _____________________,
该反应的化学平衡常数表达式K=___________,当温度升高时,K值____(增大、减小、无影响)。
16.(8分)现有含NaCl、Na2SO4和NaNO3的混合溶液,选择适当的试剂将其转化为相应的沉淀或固体,从而实现Cl-、SO42-和NO3-的相互分离。相应的实验过程如下:
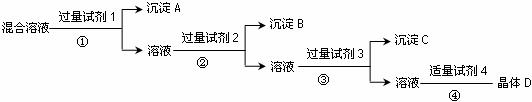 (1)写出上述实验过程中所用试剂的名称:试剂1
;试剂4
。
(1)写出上述实验过程中所用试剂的名称:试剂1
;试剂4
。
(2)操作②需要用到的仪器和用品除玻璃棒和铁架台(带铁圈)外,还有 。
(3)加入过量试剂3的目的是 。
(4)在加入试剂4后,获得晶体D的实验操作④步骤是 。(填操作名称)
15.(10分)某课外兴趣小组为了探究某种铝合金(合金元素为Mg)是否符合国家质量标准(国家规定其中铝含量不能低于78%),设计了下图装置进行实验。
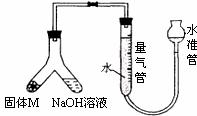
(1)如何检验该装置是否密封____________________;
(2)固体M与氢氧化钠溶液反应的离子方程式_______;
(3)倾斜A使氢氧化钠溶液(足量)与合金粉末(固体M)ag充分反应,待反应停止后,反应后进入量气管气体的体积为VmL(已折算成标准状况)。若量气管最大量程为50mL,则固体M的质量应_________;
(4)若将装置中的氢氧化钠溶液替换为足量的盐酸,则反应停止后量气管内气体体积____(填“>”、“<”、“=”) VmL。若a =38mg,V=44.8mL,该合金________(填“符合”、“不符合”)国家标准;
(5)另一兴趣小组利用该装置测定Mg的相对原子质量。需要直接测定的物理量为______;
a.加入稀硫酸(浓度已知)的体积 b.镁条的质量 c.量气管读数
若测定结果偏小,可能的原因是_____________。
a.镁条表面氧化膜未除尽 b.读取数据时水准管的水面高于量气管的水面
c.未待冷却即读取量气管读数 d.装置漏气
14.某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是
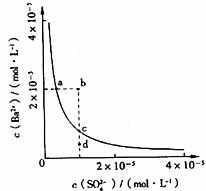
A.加入Na2SO4可以使溶液由a点变到b点 B.通过蒸发可以使溶液由d点变到c点
C.d点无BaSO4沉淀生成 D.a点对应的Ksp大于c点对应的Ksp
第二卷(非选择题 共72分)
13.已知,0.1mol/L的酸式盐NaHA溶液pH=5,且 c(H2A)>c(H+)。则下列说法(关系式)正确的是
A.c (A2-) > c(H2A) B.HA-的水解抑制了HA-的电离
C.HA-的水解和电离相互促进 D.c(OH-) = c(HA-)+c(A2-)+c(H2A)
12.已知某有机物A的红外光谱和核磁共振氢谱如下图所示,下列说法中错误的

A.由红光外谱可知,该有机物中至少有三种不同的化学键
B.由核磁共振氢谱可知,该有机物分子中有三种不同化学环境的氢原子
C.仅由其核磁共振氢谱无法得知其分子中的氢原子总数
D.若A的化学式为C2H6O,则其结构简式为CH3-O-CH3
11.“科技奥运”是2008北京奥运会的另一个主题。国家游泳中心(水立方)采用了高分子膜材料“ETFE”,该材料是四氟乙烯(CF2=CF2)与乙烯(CH2=CH2)发生聚合反应得到的高分子材料。有关ETFE下列说法错误的是
A.ETFE分子中可能存在“-CH2-CH2-CF2-CF2-”的连接方法
B.ETFE是纯净物,有固定的熔点
C.CF2=CF2和CH2=CH2均是平面型分子
D.合成ETFE的反应为加聚反应
10.下列离子方程式错误的是
A.NH4Cl溶液与NaOH溶液混合NH4+ + OH- → NH3·H2O
B.氢氧化钡溶液与硫酸溶液反应得到中性溶液
Ba2++OH-+ H++SO42- → BaSO4↓+H2O
C.NaHCO3溶液与过量的Ba(OH)2溶液混合HCO3- + Ba2+ + OH- → BaCO3↓+H2O
D.苯酚钠溶液中通入少量CO2气体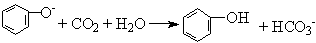
9.下图是工业电解饱和食盐水的装置示意图,下列有关说法中不正确的是
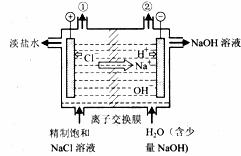
A.装置中出口①处的物质是氯气,出口②处的物质是氢气
B.该离子交换膜只能让阳离子通过,不能让阴离子通过
C.装置中发生反应的离子方程式为: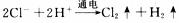
D.该装置是将电能转化为化学能
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com