
19.某有机化合物A的结构简式如下:
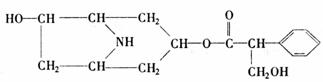
(1)A分子式是 。
(2)A在NaOH水溶液中加热反应得到B和C,C是芳香化合物。B和C的结构简式是
B: C:
该反应属于 反应。
(3)室温下,C用稀盐酸酸化得到E,E的结构简式是
(4)在下列物质中,不能与E发生化学反应的是(填写序号) 。
① 浓H2SO4和浓HNO3的混合液 ②CH3CH2OH(酸催化) ③CH3CH2CH2CH3
④Na ⑤ CH3COOH(酸催化)
(5)写出同时符合下列两项要求的E的同分异构体的结构简式(写出其中的两种)。
①化合物是1,3,5-三取代苯
②苯环上的三个取代基分别为甲基、羟基和含有?C=O?结构的基团。
18.(10分)石灰石的主要成份是碳酸钙,含氧化钙约 40~50% ,较好的石灰石含 CaO 约 45~53% 。此外还有 SiO2 、 Fe2O3 、 Al2O3 及 MgO 等杂质。测定石灰石中钙的含量时将样品溶于盐酸,加入草酸铵溶液,在中性或碱性介质中生成难溶的草酸钙沉淀
(CaC2O4·H2O),将所得沉淀过滤、洗净,用硫酸溶解,用标准高锰酸钾溶液滴定生成的草酸,通过钙与草酸的定量关系,间接求出钙的含量。 涉及的化学反应为:
H2C2O4 + MnO4- + H+ → Mn2+ + CO2 ↑+ H2O(未配平)CaC2O4 沉淀颗粒细小,易沾污,难于过滤。为了得到纯净而粗大的结晶,通常在含 Ca2+的酸性溶液中加入饱和
(NH4)2C2O4 ,由于 C2O42- 浓度很低,而不能生成沉淀,此时向溶液中滴加氨水,溶液中 C2O42- 浓度慢慢增大,可以获得颗粒比较粗大的 CaC2O4 沉淀。沉淀完毕后,pH应在3.5~4.5,这样可避免其他难溶钙盐析出,又不使 CaC2O4 溶解度太大。
根据以上材料回答下列问题:
(1)样品溶于盐酸后得到的沉淀物主要是
(2)沉淀 CaC2O4要加入沉淀剂饱和的 (NH4)2C2O4 溶液,为什么?
(3)工业中通常先用0.1%草酸铵溶液洗涤沉淀,再用冷的蒸馏水洗涤,其目的是:
(4)写出硫酸溶解草酸钙沉淀的离子方程式:
(5)若开始用去m g样品,最后滴定用去浓度为C mol/L 的KMnO4 溶液 v ml,推出CaO含量与 KMnO4的定量计算关系。ω%=
17.(11分)某化学兴趣小组全体同学进入一家回收含铜电缆废料的工厂做社会调查,工厂负责人向同学们展示两个处理方案,并向同学们提出下列问题:
方案甲:
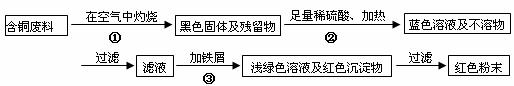
方案乙:

(1)两个方案哪个符合当前生产的绿色理念,为什么?
;
(2)写出方案甲中的②③步骤反应的离子方程式:
;
(3)工厂负责人指出,无论是甲还是乙的方案,在“加铁屑”这一步时,应该加入略过量的铁屑,你认为这么说的道理是: ;
(4)用简便方法检验红色粉末中是否含有过量的铁屑 如果有,请你提出合理的处理方案
(5)为了增加经济效益,该工厂把最后一步所得浅绿色滤液通过 、冷却结晶、
、洗涤、自然干燥得到一种俗称“绿矾”的工业产品。
16.(11分)A、B均为无色盐溶液,B的焰色反应呈黄色,一定条件下A、B可以发生图所示的物质之间的一系列变化:若E和F均为有刺激性气味的气体,H不溶于酸,请填写下列空白。

(1)气体E的化学式为 ,气体F的化学式为 ,C中溶质的化学式为 。
(2)写出下列反应的离子方程式:
C→E ;
D+G→H ;
(3)在混合溶液G中滴人几滴石蕊溶液,可见现象为 ,
原因是 。
15.(12分) I.课本中介绍了乙醇氧化的实验:把一端弯成螺旋状的铜丝放在酒精灯外焰加热,待铜丝表面变黑后立即把它插入盛有约2 mL乙醇的试管里,反复操作几次。注意闻生成物的气味,并观察铜丝表面的变化。
⑴实验室可用化学方法替代“闻生成物的气味”,写出该化学方法的化学反应方程式
。
⑵某同学在探究“闻生成物的气味”的替代方法时,偶然发现向溴水中加入乙醛溶液,溴水褪色。该同学为解释上述现象,提出两种猜想:①溴水将乙醛氧化为乙酸;②溴水与乙醛发生加成反应。请你设计一个简单的实验,探究哪一种猜想正确?
Ⅱ.某课外活动小组利用下图装置进行乙醇的催化氧化实验并制取乙醛(试管丙中用水吸收产物),图中铁架台等装置已略去。实验时,先加热玻璃管中的铜丝,约lmin后鼓入空气。请填写下列空白:
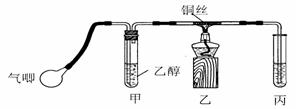
⑴实验时,常常将甲装置浸在70℃-80℃的水浴中,目的是① ____;由于装置设计上的缺陷,实验进行时可能会 ②_____
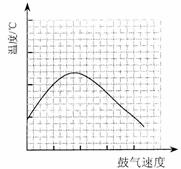
⑵反应发生后,移去酒精灯,利用反应自身放出的热量可维持反应继续进行。进一步研究表明,鼓气速度与反应体系的温度关系曲线如图所示。试解释鼓气速度过快,反应体系温度反而下降的原因:③ ;你认为该实验中“鼓气速度”这一变量可用
④ 来计量
14.下列溶液中有关微粒的物质的量浓度关系正确的是
A.NaHSO3和NaHCO3的中性混合溶液中(S和C均用R表示):
c(Na+)=c(HRO3-)+2c(RO32-)
B.常温下将醋酸钠、盐酸两溶液混合后,溶液呈中性,则混合后溶液中:
c(Na+)>c(Cl-)>c(CH3COOH)
C.常温下物质的量浓度相等的①(NH4)2CO3、②(NH4)2SO4、
③(NH4)2Fe(SO4)2三种溶液中c(NH4+):①<③<②
D.等体积等物质的量浓度的NaClO(aq)与NaCl(aq)中离子总数多少:N前<N后
13.能正确表示下列反应的离子方程式是:
A.FeBr2溶液中加入过量的氯水 2Fe2++2Br-+2Cl2 ==Br2+4Cl-+2Fe3+
B.向小苏打溶液中加入醋酸 CO32-+ 2CH3COOH=CO2↑+ H2O+ 2CH3COO-
C.向碳酸氢铵溶液中加入少量氢氧化钠 HCO3-+OH-=CO32-+ H2O
D.用碳酸钠溶液吸收少量二氧化硫 2CO32-+SO2+H2O ==2HCO3-+SO32-
12.已知下列两个气态物质之间的反应:C2H2(g)+H2(g) C2H4(g)……①,
C2H4(g)……①,
2CH4(g)  C2H4(g)+2H2(g)……②。已知在降低温度时①式平衡向右移动,②式平衡向左移动,则下列三个反应:
C2H4(g)+2H2(g)……②。已知在降低温度时①式平衡向右移动,②式平衡向左移动,则下列三个反应:
C(s)+2H2(g)  CH4(g) ;ΔH=-Q1……Ⅰ
CH4(g) ;ΔH=-Q1……Ⅰ
C(s)+1/2H2(g)  1/2C2H2(g);ΔH=-Q2……Ⅱ
1/2C2H2(g);ΔH=-Q2……Ⅱ
C(s)+H2(g)  1/2C2H4(g);ΔH=-Q3 ……Ⅲ(Q1、Q2、Q3均为正值),“Q值”大小比较正确的是
1/2C2H4(g);ΔH=-Q3 ……Ⅲ(Q1、Q2、Q3均为正值),“Q值”大小比较正确的是
A.Q1>Q3>Q2 B.Q1>Q2>Q3 C.Q2>Q1>Q3 D.Q3>Q1>Q2
11.如图所示,向A中充入1molX和1molY,向B中充入2molX和2molY,起始VA=VB=aL,在相同温度和有催化剂的条件下,两容器中各自发生下列反应 X(g)+Y(g)  2Z(g)+W(g)达到平衡时,VA=1.2aL,则下列说法错误的是:
2Z(g)+W(g)达到平衡时,VA=1.2aL,则下列说法错误的是:

A.反应开始时,B容器中化学反应速率快
B.A容器中X的转化率为40%,且比B容器中X的转化率小
C.打开K一段时间达平衡时,A的体积为2.6aL(连通管中气体体积不计)
D.打开K达新平衡后,升高B容器温度,A容器体积一定增大
10.三氯化氮分子中每个原子其最外层均达到8电子稳定结构,且氮与氯的共用电子对偏向于氮原子。则下列关于三氯化氮的叙述正确的是
A.N元素的非金属性比Cl元素强
B.在NCl3分子中N为+3价,跟水发生水解反应的产物是HNO2和HCl
C.在NCl3分子中N为-3价,NCl3跟水发生水解反应的产物是NH3和HClO
D.NCl3跟水反应生成NH4Cl、O2和Cl2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com