
26.(6分)将3.20g Cu溶于B mol/L过量的硝酸溶液30.0 mL中,假设硝酸的还原产物只有NO2和NO,反应结束后,将所剩余溶液加水稀释至1000 mL,测得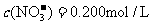 。
。
(1)试求稀释后溶液的pH。
(2)求生成的气体中NO2和NO的物质的量(可以含有B的代数式表示)。
(3)用NaOH溶液吸收氮的氧化物是防止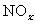 污染的一种方法。原理为:
污染的一种方法。原理为:
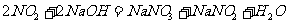 ,
,
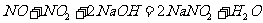
若生成的混合气体能被NaOH溶液完全吸收,试讨论B的取值范围。
25.(6分)为了测定K2CO3和NaHCO3混合物的组成,某学生每次称取一定质量的混合物溶于水配成溶液,向其中加入相同浓度的Ba(OH)2溶液,每次实验均充分反应,实验结果记录如下表:
|
实验次数 |
混合物的质量/g |
所加Ba(OH)2溶液的体积/L |
测得沉淀的质量/g |
|
l |
0.858 |
0.5 |
1.379 |
|
2 |
1.716 |
0.5 |
|
|
3 |
2.574 |
0.5 |
4.137 |
|
4 |
3.432 |
0.5 |
5.516 |
|
5 |
4.290 |
0.5 |
5.516 |
|
6 |
5.148 |
0.5 |
5.516 |
请回答下列问题:
(1)第二次实验中产生沉淀的质量是 g。
(2)混合物中K2CO3和NaHCO3的物质的量之比为 。
(3)在25℃时,取下第3组实验所得溶液体积的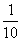 ,加水配成500mL溶液,求此溶液的pH(要求写出计算过程)。
,加水配成500mL溶液,求此溶液的pH(要求写出计算过程)。
24.(12分)据报导,目前我国结核病的发病率有抬头的趋势。抑制结核杆菌的药物除雷米封外,PAS-Na(对氨基水杨酸钠)也是其中一种。它与雷米封可同时服用,可以产生协同作用。已知
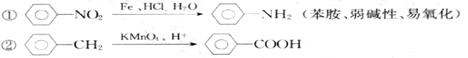
下面是PAS-Na的一种合成路线(部分反应的条件未注明):
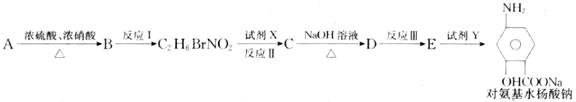
请按要求回答问题:
(1)写出下列反应的化学方程式并配平:
A+B: ;
B→C7H6BrNO2: ;
(2)写出下列物质的结构简式:C. D: ;
(3)指出反应类型:I ,Ⅱ ;
(4)指出所加试剂名称:X ,Y 。
23.(8分)2006年2月15日,中国食疗网发布“反式脂肪酸预警报告”。专家指出,摄入过多的反式脂肪酸,会导致心脑血管疾病、糖尿病,儿童若摄入过多将会影响身体发育。人造奶油、快餐中的炸鸡和炸薯条均含这种物质。反式脂肪酸是指至少含一个反式构型双键的脂肪酸。反式构型是指碳碳双键上与两个碳原子结合的氢原子分别位于双键的两侧,若两个氢原子位于双键同侧则是顺式构型。
某医学杂质上用下图表示甲、乙两种物质的结构简式,这两种结构简式虽不是很符合有机物结构简式的书写规范,但还是能够清楚地表示甲、乙两种物质的结构特征。

请根据你所学过的化学知识回答下列问题:
(1)写出甲的分子式 ,甲和乙可互称为 (填“同系物”或“同分异构体”)。你认为甲、乙两种哪一种是反式脂肪酸? 。
(2)你认为甲、乙两种物质能否在空气中燃烧? ,若你认为能够燃烧,请写出甲在足量氧气中燃烧的化学方程式: 。
(3)顺式脂肪酸多为液态,空间呈弯曲状,反式脂肪酸多为固态,空间呈线型。血液中反式脂肪酸含量过高,易使溶液堵塞血管而导致心脑血管疾病。原因是 。
(4)在油脂催化氢化(如制备人造奶油、酥油)过程中,构型会发生变化。另外,油脂长时间高温加热,也会产生反式脂肪酸。若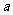 g甲转化成乙吸收Q kJ热量,写出该热化学反应方程式: (用“甲”、“乙”表示物质分子式)。
g甲转化成乙吸收Q kJ热量,写出该热化学反应方程式: (用“甲”、“乙”表示物质分子式)。
22.(5分)某些金属氧化物跟熔融烧碱反应可生成盐。根据化学反应框图(如下)填空:
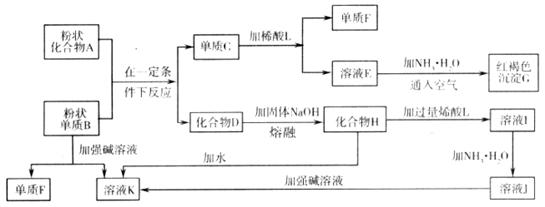
(1)单质F是 。
(2)写出由E生成G的离子反应方程式(或化学方程式) 。
(3)溶液Ⅰ中所含金属离子是 。
(4)由C制取E时若改用浓酸,则不能选用的浓酸是(写分子式) 。
21.(5分)无机过氧化合物的科学研究开始于l8世纪初,人们相继制得了过氧化钡、过氧化钠、过氧化钾、过氧化氢等,目前无机过氧化合物逐渐成为无机化学的一个分支,其中过氧化氢是用途最广的过氧化物。试回答下列问题:
(1)Na2O2、K2O2、CaO2以及BaO2都可与酸作用生成过氧化氢,目前实验室制取过氧化氢可通过上述某种过氧化物与适量稀硫酸作用,过滤即可制得。最合适的过氧化物是 。
(2)过氧化氢是一种绿色氧化剂,写出在酸性条件下H2O2氧化氯化亚铁的离子反应方程式: 。
(3)与过氧化氢具有相同电子总数且属于非极性分子的有 、 (举两例,写化学式)。
(4)纯的过氧化氢常用作火箭燃料的氧化剂,已知0.4mol液态肼(N2H4)与足量的液态过氧化氢反应,生成N2和H2O(g),放出256.6kJ的热量。则该反应的热化学方程式为 。
20.(7分)近年来,全世界经历了多种传染性疾病(如非典、疯牛病、高致病性禽流感等)的袭扰,因此,经常性地对环境进行消毒,是预防各种传染性疾病的有效措施。某研究小组为制备消毒液(主要成分是NaClO)设计了如下图所示的A、B两套装置(B装置中电极材料均为石墨),并查阅到下列资料:“在加热的情况下卤素单质和碱液发生如下反应: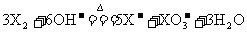 。”
。”
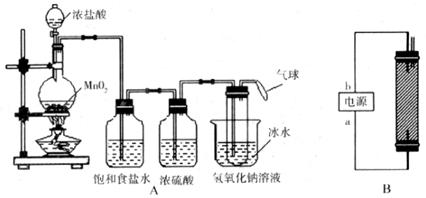
请回答下列问题:
(1)写出装置A烧瓶中发生反应的化学方程式: 。
(2)若去掉装置A中盛浓硫酸的洗气瓶,能否达到预期目的? (填“能”或“不能”)。
(3)装置A中盛冰水的烧杯的作用是 。
(4)装置B制备消毒液时有关反应的化学方程式为 。
(5)a端应接电源的 极,理由是 。
18.在pH为4-5的环境中,Cu2+、Fe2+不生成沉淀,而Fe3+几乎完全沉淀。工业上制CuCl2是将浓盐酸用蒸汽加热到80℃左右,再慢慢加入粗氧化铜(含杂质FeO),充分搅拌使之溶解。欲除去溶液中的杂质离子,下述方法正确的是
A.加入纯Cu将Fe2+还原
B.向溶液中加入(NH4)2S使Fe2+沉淀
C.直接加水加热使杂质离子水解除去
D.在溶液中通入Cl2,再加入CuO粉末调节pH为4-5
第Ⅱ卷(非选择题 共54分)
17.运用元素周期律分析下面的推断,其中肯定错误的是
A.铍(Be)的氧化物的水化物可能具有两性
B.砹(At)为有色固体;HAt不稳定;AgAt感光性很强,且不溶于水也不溶于稀酸
C.硫酸锶(SrSO4)是难溶于水的白色固体
D.硒化氢(H2Se)是无色、有毒、比H2S稳定的气体
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com