
6.能源危机是制约现代社会发展的严重问题,开发和利用新能源是中国立足自身解决能源困扰的重要举措之一。背景材料:①2005国际油价飙升,新型纳米金属燃料面世;②2006年1月1日,“苏北五市”全面推广使用乙醇汽油;③到2010年,江苏省将打造成为全国最重要的太阳能产业基地;④生物柴油是以油脂为原料,通过水解、酯化所得高级脂肪酸甲酯。下列说法正确的是
A.乙醇汽油的推广使用大大降低了国际市场的油料价格
B.生物柴油燃烧不会产生二氧化碳,是一种清洁能源
C.太阳能是一种清洁安全的不可再生能源
D.纳米金属燃料表面积大,易引发,能量释放快
29.(17分)某草酸亚铁样品( )中含有少量硫酸亚铁。现用滴定法测定该样品中FeC2O4的含量。滴定反应是:
)中含有少量硫酸亚铁。现用滴定法测定该样品中FeC2O4的含量。滴定反应是:
实验方案设计为:
①将准确称量的 草酸亚铁样品置于250 mL锥形瓶内,加入适量2 mol/L的H2SO4溶液,使样品溶解,加热至70℃左右,立即用浓度为0.02000 mol/L的高锰酸钾标准溶液滴定至终点,记下滴定管内液面读数为
草酸亚铁样品置于250 mL锥形瓶内,加入适量2 mol/L的H2SO4溶液,使样品溶解,加热至70℃左右,立即用浓度为0.02000 mol/L的高锰酸钾标准溶液滴定至终点,记下滴定管内液面读数为 mL。
mL。
②向上述滴定混合液中加入适量的Zn粉和过量的2 mol/L的H2S04溶液,煮沸5-8min,经检验溶液合格后,继续用0.02000
mol/L的高锰酸钾标准溶液滴定至终点,记下滴定管内液面读数为 mL。
mL。
③ 。
④数据处理。
请回答下列问题:
(1)上述实验方案中的步骤③是 。
(2)洁净的滴定管在滴定前必须进行的操作是:
i.检验活塞是否漏水。
ii. 。
iii.加入高锰酸钾标准溶液,赶走尖嘴部位的气泡,调节起始读数。
(3)步骤②中检验溶液是否合格的操作是:取l滴煮沸后的溶液滴入装有 溶液的试管中,若 ,则说明溶液合格。
(4)某小组的一次测定数据记录如下:
 /g /g |
起始读数/mL |
 /mL /mL |
 /mL /mL |
|
0.1970 |
0.00 |
31.30 |
42.40 |
根据数据计算0.1970g样品中: ;
; ; FeC2O4的质量分数为 (精确到0.01%)。
; FeC2O4的质量分数为 (精确到0.01%)。
28.(13分)已知: ,下图是五种高分子材料的合成工艺流程之一(图中A分子中的碳原子数多于D分子中的碳原子数,J不能发生银镜反应,但J有一种同分异构体能发生银镜反应):
,下图是五种高分子材料的合成工艺流程之一(图中A分子中的碳原子数多于D分子中的碳原子数,J不能发生银镜反应,但J有一种同分异构体能发生银镜反应):
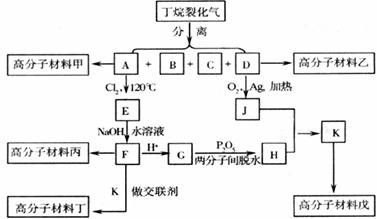

1kg优质材料丁最多能吸收近800kg水。
(1)分离丁烷裂化气中各种成分的操作方法为 ;
(2)指出下列有机反应所属的反应类型:A→E属于 反应,J+H→K属于 反应;
(3)E→F的化学方程式为(有机物一律写结构简式) ;
(4)试依次分别写出丙、戊的结构简式: 、 ;
(5)在甲、乙、丙、戊四种高分子材料中 (填“甲”“乙”“丙”或“戊”中的一种或多种)不可能具有强大的吸水能力。
27.(20分)A-M有如下图转化关系。已知D、L是相对分子质量相等的两种气体,且含有同一种元素,D是石油化工的重要基础原料,也是一种植物生长调节剂;A、E都是无色溶液,B是无色气体单质,反应②③④都是工业生产中的重要反应,H与J反应生成的溶液遇苯酚显紫色。(有些反应条件已省略)

(1)C的化学式 ,D的电子式 。
(2)上述框图中的物质能使溴水褪色的气体是 (写化学式)。
(3)反应①的化学方程式 。
(4)H与J的稀溶液反应的离子方程式 。
(5)已知生成1mol I 放出98.3 kJ的热量。写出反应③的热化学方程式 ,工业上进行这一反应的设备是 ,反应的适宜条件为 。
26.(10分)游泳池中的水经常要消毒杀菌。某化学兴趣小组对游泳池中使用的消毒剂进行了研究性学习。
(1)氯气是游泳池中水体消毒杀菌的常用消毒剂之一,它能消毒杀菌的原因是(用离子方程式表示) 。
(2)在调查某室外游泳池夏季池水消毒情况时,小组成员了解到,该游泳池每周一上午8:00换水,然后通入氯气消毒,通常游泳池水的含氯量控制在0.5mg/L至1.0 mg/L之间时,效果最好。下图是该组测定某星期中每天19︰00时游泳池中水的氯含量。根据图示判断,哪几天的天气炎热、阳光强烈,并说明理由 。

(3)游泳池也可使用漂白液(主要成分是NaClO)来进行消毒杀菌。与氯气相比较,请写出使用漂白液的优点之一 。
(4)广谱消毒剂ClO2已被世界卫生组织(WHO)列为A1级高效安全灭菌消毒剂。若消毒同一游泳池中的水,达到同样的消毒效果,所需ClO2与Cl2的物质的量之比为 。(单位物质的量的物质得到的电子数可以表示该物质的消毒效率)
(5)用于游泳池消毒杀菌的消毒剂还有很多。下列物质中,也可以用于游泳池杀菌消毒的有 。
A.二氧化硫 B.臭氧 C.活性炭 D.高锰酸钾
13.MnO2和Zn是制造干电池的重要原料,工业上用软锰矿和闪锌矿联合生产MnO2和Zn的基本步骤为:
(1)软锰矿、闪锌矿与硫酸共热:
(2)除去反应混合物中的不溶物。
(3)电解混合液:
下列说法不正确的是
A.步骤(1)中MnO2和H2SO4都是氧化剂
B.步骤(1)中每析出12.8g S沉淀共转移0.8mol电子
C.电解时MnO2在阳极处产生
D.硫酸在生产中可循环使用
第Ⅱ卷(非选择题,共l74分)
12.对于密闭容器中的反应:

 ;
; ,在673K,30MPa下
,在673K,30MPa下 和
和 随时间变化的关系如下图所示。下列叙述不正确的是
随时间变化的关系如下图所示。下列叙述不正确的是

A.点a处的止反应速率比点b处的大
B.点c处的正反应速率比逆反应速率大
C.点d(t1时刻)的 比点e(t2时刻)处的
比点e(t2时刻)处的 大
大
D.其他条件不变,773K下反应至t1时刻,此时画出的两根平行线间的距离将要变小
11.用下列实验装置进行的实验中,能达到相应实验目的的是

A.装置甲:不能防止铁钉生锈 B.装置乙:除去乙烯中混有的乙炔
C.装置丙:实验室制取乙酸乙酯 D.装置丁:验证HCl气体在水中的溶解性
10.在环境检测中常用检气管法来测定空气中SO2的含量,原理是SO2与KIO3发生反应,用一种有机物作指示剂,其可能反应如下(未配平)
①
②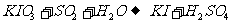 ,则下列说法正确的是
,则下列说法正确的是
A.检气管法是按照反应①原理设计的
B.检气管法是按照反应②原理设计的
C.反应①②均可以设计成检气管法,但考虑到相同量KIO3①消耗SO2少,所以检气管法是按①设计的
D.反应①②均可以设计成检气管法,但考虑到相同量KIO3①消耗SO2多,所以检气管法是按②设计的
9.已知某溶液中存在 、
、 、
、 和
和 四种离子,其浓度大小有如下关系。其中不可能的是
四种离子,其浓度大小有如下关系。其中不可能的是
① ②
②
③ 且
且 ④
④
A.①② B.②③ C.③ D.④
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com