
23.(8分)咖啡酸(下式中的A)是某种抗氧化剂成分之一,A与FeCl3溶液反应显示紫色。

(1)咖啡酸中含氧官能团的名称是 。
(2)咖啡酸可以发生的反应是 (填写序号)。
①氧化反应 ②加成反应 ③酯化反应 加聚反应 ⑤消去反应
(3)咖啡酸可看作l,3,4-三取代苯,其中两个相同的官能团位于邻位,取代基中不含支链,则咖啡酸的结构简式为 。
(4)3.6g咖啡酸与足量碳酸氢钠反应生成气体(标准状况) mL。
(5)蜂胶的主要活性成分为CPAE,分子式为C17H16O4,该物质在一定条件下可水解生成咖啡酸和一种醇,该醇为芳香醇,且分子结构中无甲基,则咖啡酸根芳香醇在一定条件下反应生成CPAE的化学方程式为 。
22.(10分)(Ⅰ)氯碱工业中用离子交换膜法电解制碱的主要生产流程示意图如下:
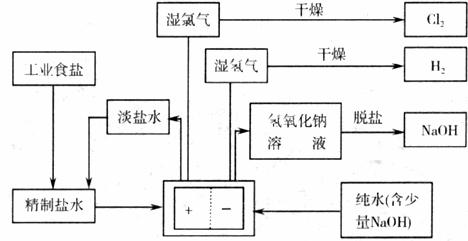
依据图完成下列填空:
(1)脱盐工序中利用NaOH和NaCI在溶解度上的差异,通过 、冷却、 (填写操作名称)除去NaCl。
(2)由图示可知用离子交换膜法电解制碱工艺中 产品可循环使用。
(3)已知NaCl在60℃的溶解度为37.1 g,现电解60℃精制饱和食盐水l371g,经分析,电解后溶液密度为1.37 g·cm-3,其中含有20g NaCl,则电解后NaOH的物质的量浓度为 mol·L-1。
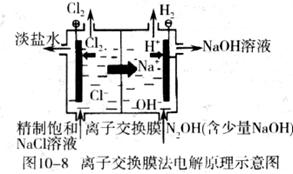
(Ⅱ)在隔膜法电解食盐水(见图10-8)过程中,与电源正极相联的电极上所发生的反应为 。与电源负极相连的电极附近溶液的pH (填“升高”、“下降”或“不变”)。若采用无隔膜法电解冷的食盐水时,Cl2与NaOH充分接触,产物仅是NaClO和H2,相应的化学方程式为 。由隔膜法电解食盐水中离子交换膜的功能,进行大胆设想,能否用电解饱和Na2SO4溶液的方法生产NaOH和H2SO4? 。若能,参照图在方框内试画出装置示意图。

21.(5分)常温下,在25 mL0.1mol·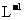 KOH溶液中逐滴加入0.2 mol·
KOH溶液中逐滴加入0.2 mol·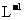 醋酸溶液,曲线如图所示,请根据图,回答有关问题:
醋酸溶液,曲线如图所示,请根据图,回答有关问题:
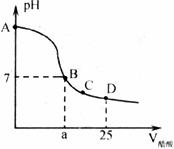
(1)在A点,溶液的pH= 。
(2)在B点,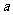 l2.5(填“>”“=”或“<”,下同)
l2.5(填“>”“=”或“<”,下同)
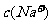 、
、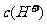 、
、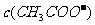 、
、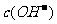 的大小关系为:
的大小关系为:
(3)在C点,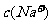 、
、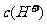 、
、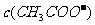 、
、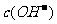 由大到小的顺序为: 。
由大到小的顺序为: 。
(4)在D点,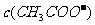 与
与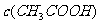 之和与
之和与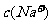 的关系为(用关系式表示): 。
的关系为(用关系式表示): 。
20.(8分)(1)发射卫星时可用肼(N2H4)为燃料和二氧化氮作氧化剂,两者反应生成氮气和气态水。
已知: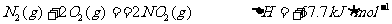
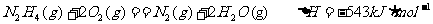
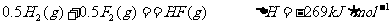
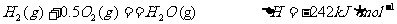
①肼和NO2反应的热化学方程式: 。
②有人认为若用氟气代替二氧化氮作氧化剂,则反应释放的能量更大,肼和氟气反应的热化学方程式: 。
(2)最近,又有科学家制造出一种使用固体电解质的燃料电池,其效率更高。一个电极通入空气,另一个电极通入汽油蒸汽。其中固体电解质是掺杂了Y2O3(Y:钇)的ZrO2(Zr:锆)固体,它在高温下能传导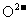 离子(其中氧化反应发生完全)。以丁烷(C4H10)代表汽油。
离子(其中氧化反应发生完全)。以丁烷(C4H10)代表汽油。
①电池的正极反应式为 ;
②放电时固体电解质里的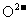 离子的移动方向是向 极移动(填正或负)。
离子的移动方向是向 极移动(填正或负)。
19.(7分)麻醉剂的发现和使用,是人类医疗史上了不起的-项成就,它可使患者在接受治疗时感觉不到疼痛。
(1)笑气是人类最早应用于医疗的麻醉剂之一,它可由NH4NO3在微热条件下分解产生,产物除N2O外还有一种,写出此反应的化学方程式: 。生成1mol N2O时反应中转移的电子数为 mol。
(2)另一种常用麻醉剂氯仿,常因保存不慎而被氧化,产生剧毒物质--光气(COCl2):2CHCl3+O2==2HCl+2COC12,写出光气的电子式: 。为了防止发生事故,使用前要先检验氯仿是否变质,写出检验所用的试剂: 。
(3)锡在元素周期表中位于第 周期、第 族,砷的原子序数为 。
(4)氙的化学性质不活泼,但它的确可在一定条件下生成化合物。现取1mol氙气和3.5mol氟气于密闭容器中,后来余下了0.5mol氟气,同时有白色固体形成,此白色固体的化学式为 。
18.下图为分离乙酸乙酯、乙酸和乙醇混合物的实验操作流程图
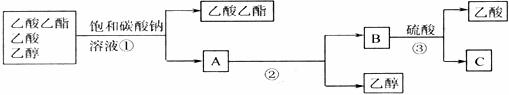
在上述实验过程中,所涉及的三次分离操作分别是
A.①蒸馏,②过滤,③分液 B.①分液,②蒸馏,③蒸馏
C.①蒸馏,②分液,③分液 D.①分液,②蒸馏,③结晶、过滤
第Ⅱ卷(非选择题 共64分)
17.下列中学常见实验的现象或表述正确的是
A.做温度对化学平衡影响的实验,将装有NO2与N2O4混合气体的两个玻璃球一个浸入热水,另一个浸入冷水,浸入热水的玻璃球里气体的颜色较浅
B.制备氢氧化亚铁时,向硫酸亚铁溶液中滴加氢氧化钠溶液,边加边搅拌,即可制得白色的氢氧化亚铁
C.检验红砖中的氧化铁成分,向红砖粉末中加入盐酸,充分反应后取上层清液于试管中,滴加KSCN溶液2-3滴即可
D.向CuSOa溶液中滴入过量NaOH溶液充分反应后,将混合液体倒入蒸发皿中加热煮沸一会,然后冷却、过滤,滤纸上的物质为“蓝色固体”
16.甲醇是重要的基础化工原料,又是一种新型的燃料。制取甲醇传统法是采用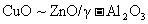 催化剂,合成反应为:CO+2H2
催化剂,合成反应为:CO+2H2 CH3OH,工艺中一些参数如图;目前正在开发的新法:2CH4+O2
CH3OH,工艺中一些参数如图;目前正在开发的新法:2CH4+O2 CH3OH,下列有关新法和旧法的说法正确的是
CH3OH,下列有关新法和旧法的说法正确的是
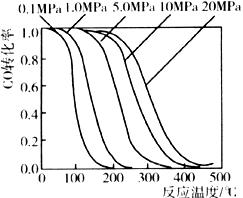
A.旧法生产中,由图知CO与H2合成甲醇的反应属于放热反应
B.旧法生产中,选择合适的催化剂时,可推测高压法合成比低压法合成更有发展优势
C.新法与旧法相比,原料丰富并可直接从天然气中获得
D.新法生产中,需控制V(CH4)/V(O2)=9︰1,目的是提高空气中氧气的转化率
15.短周期元素A、B、C的原子序数依次递增,它们的原子最外层电子数之和为10,A与C同主族,B原子的最外层电子数等于A原子的次外层电子数,则下列叙述正确的是
A.原子半径:A<B<C
B.A的氢化物稳定性大于C的氢化物稳定性
C.三种元素的最高价氧化物对应水化物均可由化合反应得到
D.高温下,B单质能置换出A单质,A单质能置换出C单质
14.实验测得,等物质的量浓度的NaOH溶液滴入CuSO4溶液中,两者体积比为1.5:1时(残存在溶液中的Cu2+极少,可认为全部转入沉淀中),所生成的沉淀的化学式是
A.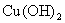 B.
B.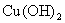 ·CuSO4
·CuSO4
C.2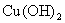 ·CuSO4 D.3
·CuSO4 D.3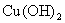 ·CuSO4
·CuSO4
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com