
15.通过对实验的观察、分析推理、得出正确的结论是化学学习的主要方法之一。对下列实验事实的解释正确的是 ( )
|
|
现象 |
解释 |
|
A |
KI淀粉溶液中通入Cl2,溶液变蓝 |
淀粉能与Cl2发生显色反应 |
|
B |
浓硝酸在光照条件下变黄 |
浓硝酸不稳定,生成有色产物能溶于浓硝酸 |
|
C |
某溶液中加入硝酸酸化的氯化钡溶液,有白色沉淀生成 |
说明该溶液中含有SO42- |
|
D |
铜片放入浓硫酸中,无明显变化 |
说明铜在冷的浓硫酸中发生钝化 |
14.下列离子在溶液中因发生氧化还原反应而不能大量共存的是( )
A.Ag+、NO3-、Cl-、K+ B.H3O+、NO3-、Fe2+、Na+
C.K+、Ba2+、OH-、SO42- D.Cu2+、NH4+、Br-、OH-
13.当电解质在溶液里达到电离平衡时,溶液中已电离的电解质分子数占原来总分子数的百分数叫做该电解质的电离度。现欲粗略测定一未知浓度的CH3COOH溶液中CH3COOH的电离度,应做的实验和所需的试剂(或试纸)是( )
A.电解、NaOH溶液 B.中和滴定(以酚酞为指示剂)、pH试纸
C.酯化反应、石蕊溶液 D.蒸馏、Na2CO3溶液
12.肼(N2H4)是火箭发动机的燃料,反应时N2O4为氧化剂,生成氮气和水蒸气。已知:
N2(g)+2O2(g)=N2O4(g);△H= +8.7KJ/mol N2H4(g)+O2(g)=N2(g)+2H2O(g);△H=-534.0kJ/mol 下列表示肼跟N2O4反应的热化学方程式,正确的是( )
A.2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g); △H=-542.7kJ/mol
B.2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g); △H=-1059.3kJ/mol
C.2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g); △H=-1076.7kJ/mol
D.N2H4(g)+1/2 N2O4(g)= 3/2N2(g)+2H2O(g);△H=-1076.7kJ/mol
11.氮化铝(AlN)具有耐高温、抗冲击、导热性好等优良性质,被广泛应用于电子工业、陶瓷工业等领域。在一定条件下,氮化铝可通过如下反应合成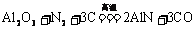 下列叙述不正确的是( )
下列叙述不正确的是( )
A.氯化铝晶体属于分子晶体
B.氮化铝中氮元素的化合价为-3
C.上述反应中每生成1molAlN,C得到3mole-
D.在氮化铝的合成反应中,N2是氧化剂,C是还原剂
10.下列说法中,不正确的是( )
A.形成化学键吸收能量,破坏化学键释放能量
B.14g乙烯和丙烯的混合物中原子的物质的量为3 mol
C.向豆浆中加入硫酸钙溶液会产生聚沉现象
D.向海水中加入净水剂明矾可以使海水淡化
9.下列离子方程式书写正确的是( )
A.氯化铝溶液中加入过量氨水:Al3++3OH-=Al(OH)3↓
B.向足量的溴化亚铁溶液中通入少量的氯气:2Fe2++Cl2=2Fe3++2Cl-
C.钠与水反应:Na+2H2O=2OH-+H2↑
D.向硅酸中加入氢氧化钠溶液:H++OH-=H2O
8.下列说法正确的是( )
A.原子晶体中一定有非极性键
B.分子晶体溶于水时,一定不破坏共价键
C.二氧化碳分子是含有极性共价键的非极性分子
D.过氧化钠属离子晶体,且阴阳离子的个数比为1︰1
7.海水淡化可采用膜分离技术。如下图所示,对淡化膜右侧的海水加压,水分子可以透过淡化膜进入左侧淡水池,而海水中其它各种离子不能通过淡化膜,从而得到淡水。对加压后右侧海水成分变化分析正确的是( )
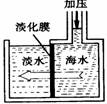
A.溶质质量增加 B.溶液质量不变 C.溶剂质量减少 D.溶质质量分数减少
6.向含下列微粒的溶液中,①HS-、②Fe2+、 ③CH3COO-、④NH2-CH2COOH分别加入少量氢氧化钠固体或少量浓盐酸(溶液体积变化忽略不计),都使溶液中对应的离子或分子浓度减小的是( )
A.①② B.②③ C.①④ D.③④
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com