
27.(14分)某二元酸(化学式用H2A表示)在水中的电离方程式是:
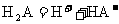



回答下列问题:
(1)Na2A溶液显 (填“酸性”、“中性”或“碱性”)。理由是 ___ (用离子方程式表示)。
(2)在0.1mol·L的Na2A溶液中,下列微粒浓度关系式正确的是( )
A.
B. 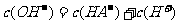
C.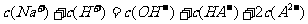
D.
(3)已知0.1mol·L-1NaHA溶液的pH=2,则0.1mol·L-1H2A溶液中氢离子的物质的量浓度可能是 0.11 mol·L-1(填“>”、“<”或“=”),理由是: 。
(4)0.1mol·L-1NaHA溶液中各种离子浓度由大小的顺序是: 。
26.(15分)元素X、Y、Z、W为短周期元素,且原子序数依次增大,已知Y原子最外层电子数占核外电子总数的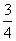 ,
,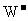 、
、 、
、 半径逐渐减小,化合物XW常温下为气体,据此回答下列问题:
半径逐渐减小,化合物XW常温下为气体,据此回答下列问题:
(1)A、B均为由上述四种元素中的三种组成的强电解质,且常温下两种物质的水溶液pH均大于7,组成元素的原子数目之比均为1︰1︰1。若A能抑制水的电离,而B促进水的电离,则A的电子式为 。B的化学式 。
(2)简要说明A溶液中水的电离程度比B溶液中水的电离程度小的原因 。
(3)用B在碱性条件下可以处理含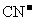 的工业废水,请将下列6种微粒,
的工业废水,请将下列6种微粒,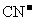 、
、 、N2、
、N2、 、B中阴离子、B中所含元素W的阴离子,分别填入下面对应横线上,组成一个未配平的化学方程式(同一端的顺序任意):
、B中阴离子、B中所含元素W的阴离子,分别填入下面对应横线上,组成一个未配平的化学方程式(同一端的顺序任意):

反应物中发生氧化反应的物质是 ,1mol氧化剂得 mol电子。反应式配平后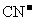 的系数是 。
的系数是 。
13.下列说法正确的是
A.常温常压下,28g乙烯与28g丙烯中均含有6NA对共用电子对
B.标准状况下,1mol H2O2完全分解时转移电子2NA个
C.常温常压下,3.5g 所含中子数为3.6 NA
所含中子数为3.6 NA
D.在常温、常压条件下,22.4 LO3气体中含有3NA个原子
第Ⅱ卷(非选择题 共174分)
12.1L 0.1mol·L-1的氨水中所含溶质微粒的物质的量是
A.0.1mol NH3分子
B.0.1mol NH3·H2O分子
C.NH3分子和NH3·H2O分子共0.1mol
D.NH3分子、NH3·H2O分子、 离子共0.1mol
离子共0.1mol
11.某有机物室温时为气态,完全燃烧后,生成的H2O和CO2的物质的量之比为3︰4。只含有一个官能团的链烃的同分异构体的数目有
A.2 B.3 C.4 D.5
10.由实验事实得出的结论,其中正确的是
|
|
实验事实 |
结论 |
|
A |
Cl2的水溶液能导电 |
Cl2是电解质 |
|
B |
SO2通入硝酸钡溶液出现白色沉淀 |
BaSO3不溶于强酸 |
|
C |
金属钠与乙醇反应不如钠与水反应剧烈 |
乙醇分子中的羟基氢原子不如水分子中的氢原子活泼 |
|
D |
加热煮沸滴有石蕊试液的SO2水溶液,红色褪去 |
SO2具有漂白性 |
9.在周期表的前三个周期中,位置相邻的三种元素的质子数之和为33,则有关这三种元素的下列说法正确的是
A.可能在同一周期 B.可能在同一主族
C.可能有两种元素在第VA族 D.可能有两种元素在第三周期
8.下列各项中的两个量,其比值一定为1︰1的是
A.常温下,pH=11的氨水和pH=11的NaOH溶液中的 和
和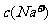
B.在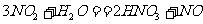 的反应中氧化产物与还原产物的物质的量
的反应中氧化产物与还原产物的物质的量
C.在一定条件下,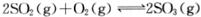 达平衡时,
达平衡时,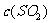 与
与
D.液面在“0”刻度时,25.00mL酸式滴定管与25.00mL碱式滴定管所盛溶液的体积
7.pH=3的醋酸溶液加水冲稀到原溶液体积的3倍,则稀释后的pH为
A.3.2 B.3.5 C.3.7 D.4
6.下列描述的现象中,不可能发生的是
A.银在900℃熔化
B.浓硫酸中加水后密度增大
C.水在111℃沸腾
D.1mol水蒸气在标准状态下的体积约为22.4L
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com