
4.下列说法中正确的是
A、镍氢电池、锂离子电池和碱性锌锰干电池都是二次电池
B、燃料电池是一种高效但是会污染环境的新型电池
C、化学电池的反应基础是氧化还原反应
D、铅蓄电池放电的时候正极是Pb负极是PbO2
3.近20年来,同位素分析法在植物生理学、生态学和环境科学研究中获得广泛应用,如在
陆地生态系统研究中,2H、13C、15N、18O、34S等常用做环境分析指示物。下列说法中正确的是
A.34S原子核内的中子数为16 B.1H216O比1H218O的摩尔质量小
C.13C和15N原子核内的质子数相差2 D.2H+的酸性比1H+的酸性更强
2.下列事实得出的结论错误的是
A.维勒用无机物合成了尿素,突破了无机物与有机物的界限
B.门捷列夫在前人的基础上发现了元素周期律,表明科学研究既要继承又要创新
C.C60是英国和美国化学家共同发现的,体现了国际科技合作的重要性
D.科恩和波普尔因理论化学方面的贡献获诺贝尔化学奖,意味着化学已成为以理论研究为主的学科
1.下列叙述合理的是
A.金属材料都是导体,非金属材料都是绝缘体
B.棉、麻、丝、毛及合成纤维完全燃烧都是只生成CO2和H2O
C.水电站把机械能转化成电能,而核电站把化学能转化成电能
D.我国规定自2008年6月1日起,商家不得无偿提供塑料袋,目的是减少“白色污染”
24.(13分)钴(Co)的化合物是一类重要化合物,在科学研究和生产中都有广泛的应用。某科研小组为测定某钴化合物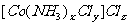 的组成,进行如下实验:
的组成,进行如下实验:
①称取样品0.2505g,加入过量的NaOH溶液,煮沸,蒸出所有的氨,冷却,得到A。产生的氨用50.00mL0.5000mol·L-1的盐酸完全吸收,并用蒸馏水定容至100mL,得溶液B。取B溶液20.00mL,用0.1000mol·L-1 NaOH滴定,消耗NaOH溶液40.00mL。
②向A中加入过量KI固体,振荡,盐酸酸化后置于暗处,发生反应:
 (未配平)
(未配平)
反应完成后,蒸馏水稀释,用Na2S2O3溶液滴定析出的I2,消耗0.1000mol·L-1 Na2SO3溶液20.00mL。反应方程式为: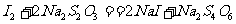 12+2Na2。
12+2Na2。
③另称取该物质样品0.2505g,溶于水,以0.1000mol·L-1 AgNO3溶液滴定至恰好反应完全,消耗AgNO3溶液20.00mL。相应反应式为:
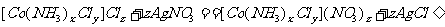
通过计算求:
(1)写出用氢氧化钠溶液滴定溶液B时的离子方程式。
(2)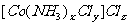 中氮元素的质量分数。
中氮元素的质量分数。
(3)请写出该钴化合物的化学式,写出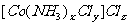 溶于水时的电离方程式。
溶于水时的电离方程式。
23.(5分)下图为某市售盐酸试剂瓶标签上的部分数据。问:

(1)在标准状况下,1体积水吸收多少体积的HCl气体可制得上述盐酸。(水的密度以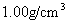 计)
计)
(2)取该盐酸25.4mL与2.00mol·L-1的氢氧化钠溶液100mL混合,再将混合后溶液稀释至1.00L,此时溶液的pH约为多少?
22.(13分)煤的气化和液化是高效、清洁地利用煤的重要方法。该方法的化学反应主要是碳和水蒸气反应生成A,B的混合气体,然后再利用它们合成多种有机物。下图是某些物质的合成路线。A与B按不同比例可生成C,D,E。其中F是一种无色、有刺激性气味的气体,是家庭装潢常见污染物,C可分别与钠和银氨溶液反应。
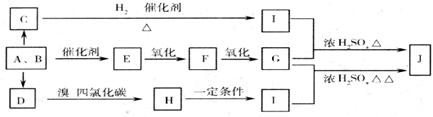
请回答:
(1)经测定,有机物J中碳、氢元素质量分数依次为40.68%、5.08%,其余为氧元素。J对H2的相对密度是59。写出J的分子式: 。
(2)写出下列物质的结构简式:E C 。
(3)简述配制银氨溶液的操作: 。
(4)写出下列化学反应方程式,并注明反应类型。
G+I→J ,类型 。
H→I ,类型: 。
(5)写出一种属于酯类,且与J互为同分异构体的结构简式: 。
21.(11分)某酯X只含碳、氢、氧二种元素,1mol X与稀硫酸溶液共热可生成1mol甲酸、1mol乙醇和1mol芳香族化合物A。A的相对分子质量不超过150,其中含碳元素质量分数为60.9%,含氧元素的质量分数为34.8%,且苯环上的一卤代物只有2种。
(1)A的分子式是 。
(2)A中含有的官能团名称: 。
(3)X与稀硫酸溶液反应的化学方程式: 。该反应类型是 。
(4)写出A与NaHCO3溶液反应的化学方程式: 。
(5)A的一种同分异构体B,其苯环上的一氯取代物有两种,1mol B能与3mol NaOH溶液恰好完全反应。B的结构简式为 。
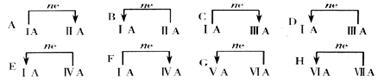
20.(9分)不同族元素之间的置换反应,请你按下列要求举出反应方程式:
19.(13分)化学键的键能是指气态原子间形成1mol化学键时释放的能量。如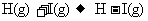 ;
;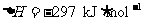 即H-I键的键能为297kJ·mol-1,也可以理解为破坏1mol H-I键需要吸收297kJ的热量。一个化学反应一般都有旧化学键的破坏和新化学键的形成。下表是一些键能数据
即H-I键的键能为297kJ·mol-1,也可以理解为破坏1mol H-I键需要吸收297kJ的热量。一个化学反应一般都有旧化学键的破坏和新化学键的形成。下表是一些键能数据
|
化学键 |
键能 |
化学键 |
键能 |
化学键 |
键能 |
化学键 |
键能 |
|
H-H |
436 |
C1-Cl |
243 |
H-Cl |
432 |
H-O |
464 |
|
S-S |
255 |
H-S |
339 |
C F |
427 |
C-O |
347 |
|
C-Cl |
330 |
C-I |
218 |
H-F |
565 |
|
|
回答下列问题:
(1)由表中数据能否得出这样的结论:①半径越小的原子形成的共价键越牢固(即键能越大) (填“能”或“不能”);②非金属性越强的原子形成的共价键越牢同 (填“能”或“不能”)。能否从数据找出一些规律,请写出一条: ;试预测C-Br键的键能范围: <C-Br键能< 。
(2)由热化学方程式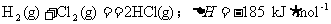 ,并结合表上数据可推知一个化学反应的反应热(设反应物生成物均为气态)与反应物和生成物的键能之间的关系是 ,由热化学方程式
,并结合表上数据可推知一个化学反应的反应热(设反应物生成物均为气态)与反应物和生成物的键能之间的关系是 ,由热化学方程式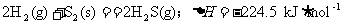 和表中数值可计算出1 mol S2(s)气化时将 (填“吸收”或“放出”) kJ的热量。
和表中数值可计算出1 mol S2(s)气化时将 (填“吸收”或“放出”) kJ的热量。
(3)卤代烃RX在同样条件下发生碱性水解反应时,RF、RCl、RBr、RI(R相同)的反应活性由大到小的顺序是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com