
18. (14分)(1)把一块纯净的锌片插入装有稀硫酸的烧杯里,可观察锌片上有气泡,再平行插入一块铜片,可观察到铜片 (填“有”或“没有”)气泡产生。再用导线把锌片和铜片连接起来(见下图A),组成一个原电池,负极为 ,正极的电极反应式为 ;

(2)如果烧杯中最初装入的是2mol/L 500mL的稀硫酸溶液,构成铜锌原电池(见上图B,假设产生的气体没有损失),当在标准状况下收集到11.2L的氢气时,则此时烧杯内溶液中硫酸的物质的量浓度为(溶液体积变化忽略不计) _________ ;
(3)金属的腐蚀分为两种:化学腐蚀(与化学物质直接接触而发生化学反应)和电化学腐蚀(由于构成原电池而发生电极反应),把铁片和石墨棒用导线相连插入氯化钠溶液中(见上图C),放置数天后,主要发生 腐蚀,写出有关反应式______________
_________________ ;(化学腐蚀写化学方程式,电化学腐蚀写电极反应式)
(4)生活中利用原电池原理生产了各样的电池,废电池必须进行集中处理的问题已被提到议事日程,其主要原因是 。
A、回收利用电池外壳的金属
B、防止电池中汞、镉和铅等重金属离子对土壤、水源的污染
C、防止电池中渗泄的电解液腐蚀其他物品
D、回收其中石墨电极
17.(18分)⑴在下列事实中,什么因素影响了化学反应的速率?
①夏天的食品容易霉变,冬天就不容易发生该现象 ;
②熔化的氯酸钾放出气泡很慢,撒入少量二氧化锰很快产生气体 ;
③工业上常将固体燃料粉碎,以提高燃烧效率 ;
④同浓度的硫酸和盐酸与大小且质量相同的锌粒反应,产生气体硫酸快、盐酸慢 ;
⑤集气瓶中H2和Cl2的混合气体,在瓶外点燃镁条时发生爆炸 。
⑵在2L容器中3种物质间进行反应,X、Y、Z的物质的量随时间的变化曲线如下图。反应在t时到达平衡,依图所示:
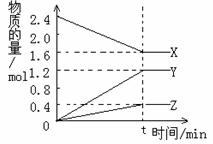
①该反应的化学方程式是 。
②反应起始至t,Y的平均反应速率是 。
③X的物质的转化率是__________________。
④关于该反应的说法正确的是_________
A.到达t时刻该反应已停止;
B.在t时刻之前X的消耗速率大于它的生成速率;
C.在t时刻正反应速率等于逆反应速率;
D.在t时刻达到平衡是因为此时反应物总物质的量与生成物总物质的量相等。
16.(8分)(1)氢气在氯气中燃烧,在反应过程中,破坏1 mol 氢气中的化学键消耗的能量为Q1kJ,破坏1 mol 氯气中的化学键消耗的能量为Q2KJ,形成1 mol 氯化氢中的化学键释放的能量为Q3kJ。则Q1、 Q2 、Q3的关系是 。
(2)反应A+3B==2C+2D在四种不同情况下的反应速率分别为:
①v(A)=0.15 mol·L-1·s-1; ②v(B)=0.6mol·L-1·s-1;
③v(C)=0.4 mol·L-1·s-1; ④v(D)=0.45 mol·L-1·s-1。该反应进行的快慢顺序为 。(用序号和“>”号表示)
15.电子表中电子计算器的电源常用微型银锌原电池,其电极分别为Ag2O和Zn,电解质溶液为KOH溶液,放电时锌极上的电极反应是:Zn+2OH--2e-=Zn(OH)2;氧化银电极上的反应式为:Ag2O+H2O+2e-=Ag+2OH-,总反应式为:Ag2O+H2O+Zn=Zn(OH)2+2Ag。下列说法正确的是:
A.锌是负极,氧化银是正极
B.锌发生还原反应,氧化银发生氧化反应
C.溶液中OH-向负极移动,K+、H+向正极移动
D.随着电极反应的不断进行,电解质溶液的pH逐渐增大
14.将 4 mol A 气体和 2 mol B 气体在 2 L 的容器中混合并在一定条件下发生如下反应
2A(g)+B(g) 2C(g)。若经 2 s(秒)后测得 C 的浓度为 0.6 mol·L-1
,现有
2C(g)。若经 2 s(秒)后测得 C 的浓度为 0.6 mol·L-1
,现有
下列几种说法:
① 用物质 A 表示的反应的平均速率为 0.3 mol·(L·s)-1
② 用物质 B 表示的反应的平均速率为 0.6 mol·(L·s)-1
③ 2 s 时物质 A 的转化率为30%
④ 2 s 时物质 B 的浓度为 1.4mol·L-1
其中正确的是
A.①③ B.①④ C.②③ D.③④
13.在一定温度下,均能形成单键的A2、B2、AB三种分子有如下反应发生:
A2(g)
+ B2(g)  2AB(g),该反应达到平衡时的标志是
2AB(g),该反应达到平衡时的标志是
A.A2的生成速率与AB的分解速率相等
B.单位时间内生成 2 n mol AB, 同时消耗 n mol A2
C.单位时间内1mol A-A键断裂,同时断裂2 mol A-B
D.A2、B2、AB的浓度不再变化,且A2、B2、AB的分子数之比为1:1:2
12.下列措施可以提高燃料燃烧效率的是
①固体燃料粉碎 ②液体燃料雾化 ③煤经气化处理 ④通入过量的空气
A.①③ B.①②③ C.①③④ D.全部
11.在一定温度下的恒容的密闭容器中,当下列物理量不再发生变化时,反应
A(g)+2B(g)
 C(g) +D(g),不能表明已达到平衡状态的是
C(g) +D(g),不能表明已达到平衡状态的是
A.B物质的量浓度 B.混合气体的密度
C.混合气体的压强 D.混合气体的平均相对分子量
10. 有A、B、C、D四种金属,将A与B用导线联结起来,浸入电解质溶液中,B不易腐蚀。将A、D分别投入等物质的量浓度盐酸中,D比A反应剧烈。将铜浸入B的盐溶液里,无明显变化,如果把铜浸入C的盐溶液里,有金属C析出。据此判断它们的活动性由强到弱的顺序是:
A、A>D>B>C B、D>A>B>C C、D>A>C>B D、C>B>A>D
9.关于用水制取氢气,以下研究方向正确的是
A.构成水的氢是可燃物,因此可研究在水分解的情况下,使氢成为一次能源
B.电解水产生氢气并释放能量
C.寻找高效催化剂,使水分解产生氢气,同时释放能量
D.寻找特殊催化剂,利用太阳光或其它方式分解水制取氢气
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com