
5.下述关于烃的说法中,正确的是 ( )
A.烃是指仅含有碳和氢两种元素的有机物
B.烃是指分子里含碳元素的化合物
C.烃是指燃烧反应后生成二氧化碳和水的有机物
D.烃是指含有碳和氢元素的化合物
4.可以用分液漏斗进行分离的混合物是 ( )
A.酒精和碘水 B.苯和氯化钠水溶液
C.乙醇和乙酸乙酯 D.乙酸和水
3.下列物质中,不属于有机物的是 ( )
A.尿素 B.酒精 C.苏打 D.塑料
2.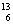 C-NMR(核磁共振)可以用于含碳化合物的结构分析,有关
C-NMR(核磁共振)可以用于含碳化合物的结构分析,有关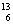 C的说法正确的是( )
C的说法正确的是( )
A.质子数为6 B.电子数为13 C.中子数为6 D.质量数为6
1.通常用于衡量一个国家石油化工发展水平的标志是 ( )
A.石油的产量 B.乙烯的产量 C.天然气的产量 D.硫酸的产量
23.(9分)在密闭容器中,将1.0mol CO与1.0mol H2O混合加热到800℃,发生下列反应: CO(g)+H2O(g) CO2(g)+H2(g)
CO2(g)+H2(g)
一段时间后该反应达到平衡,测得CO的物质的量为0.5mol。回答下列问题:
(1) 平衡时CO的转化率为 ,该反应的化学平衡常数为 。
(2) 如果继续向该平衡体系中通入1.0mol的H2O(g),相同条件下反应达到新的平衡状态,则CO的转化率将 (填“增大”、“减小”、“不变”),预计CO的转化率为 。
(3) 427℃时该反应的平衡常数为9.4,请结合①中的计算结果判断该反应的△H 0(填“>”、“==”、“<”)。
22.(8分)氨是最重要的氮肥,是产量最大的化工产品之一。课本里介绍的合成氨技术叫哈伯法,是德国人哈伯在1905年发明的,其合成原理为:N2(g)+3H2(g)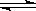 2NH3(g);△H=-92.4kJ/mol他因此获得了1918年诺贝尔化学奖。试回答下列问题:
2NH3(g);△H=-92.4kJ/mol他因此获得了1918年诺贝尔化学奖。试回答下列问题:
(1)合成氨工业中采取的下列措施可用勒夏特列原理解释的是 (填序号)
A 采用较高压强(20Mpa~50Mpa) B 采用500℃的高温 C 用铁触媒作催化剂
D 将生成的氨液化并及时从体系中分离出来,N2和H2循环到合成塔中并补充N2和H2
(2)下图是实验室模拟工业法合成氨的简易装置。简述检验有氨气生成的方法 。
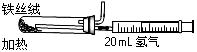
(3)在298K时,将10mol N2和30mol H2放入合成塔中,为何放出的热量小于924kJ?
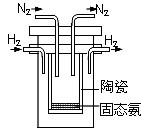
(4)1998年希腊亚里斯多德大学的Marmellos和Stoukides采用高质子导电性的SCY陶瓷(能传递H+),实现了高温常压下高转化率的电化学合成氨。其实验装置如图。正极的电极反应式
21.(5分)某研究性学习小组对铝热反应实验展开研究。现行高中化学教材(必修加选修)中对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”。查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:
|
物质 |
Al |
Al2O3 |
Fe |
Fe2O3 |
|
熔点/℃ |
660 |
2054 |
1535 |
1462 |
|
沸点/℃ |
2467 |
2980 |
2750 |
-- |
(1)某同学推测,铝热反应所得到的熔融物应是铁铝合金。理由是:该反应放出的热量使铁熔化,而铝的熔点比铁低,此时液态的铁和铝熔合形成铁铝合金。你认为他的解释是否合理?答: (填“合理”或“不合理”)
(2)设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所用试剂是 ,反应的离子方程式为 。
20.(7分)红矾钠(重铬酸钠:Na2Cr2O7·2H2O)是重要的基本化工原料,在印染工业、电镀工业和皮革工业中作助剂,在化学工业和制药工业中也用作氧化剂,应用领域十分广泛。
(1)实验室中红矾钠可用铬铁矿(主要成分:FeO·Cr2O3)利用以下过程来制取。
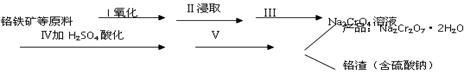
① 步骤I中反应的化学方程式为:
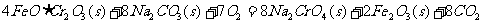 ,该反应的化学平衡常数的表达式为 。
,该反应的化学平衡常数的表达式为 。
②步骤Ⅳ中发生反应的离子方程式为: 。
(2)将红矾钠与KCl固体1:2(物质的量比)混合溶于水后经适当操作可得到K2Cr2O7晶体。请填写表中空格。完成上述过程。
|
序号 |
实验步骤 |
简述实验操作(不必叙述如何组装实验装置) |
|
① |
溶解 |
将混合物放入烧杯中,加水,充分搅拌直到固体不再溶解。 |
|
② |
|
|
|
③ |
|
|
|
④ |
|
|
|
⑤ |
过滤、干燥 |
得到K2Cr2O7晶体 |
19.(12分)火柴头上通常含有氯酸钾、二氧化锰、硫等物质。某研究性学习小组进行火柴头中有关物质的实验探究。
⑴.检验火柴头中含有硫
将两根火柴放在如下图所示实验装置中漏斗下面,用一根燃着的火柴点燃它,慢慢拉动注射器活塞抽气,让火柴燃烧产生的气体通过稀品红溶液,观察到品红溶液褪色。
① 燃烧产生的气体中一定含有 ;
② 可用于替代试管中品红溶液的试剂有 (填标号)
A.稀高锰酸钾酸性溶液 B.饱和石灰水 C.稀溴水 D.烧碱溶液
③ 某同学提出用下图所示方法进行实验更为简便。他的操作是:
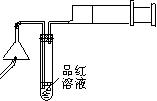
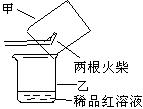
ⅰ.当图中所示火柴头燃烧完时,立即移出火柴;ⅱ. 。
⑵.测定火柴头中KClO3的含量
主要实验步骤如下:
ⅰ 刮取火柴头,小心研碎,称得质量为2.45g;
ⅱ 用适量蒸馏水充分浸泡后过滤、洗涤残渣;
ⅲ 往装有滤液和洗涤液的烧杯中加入过量的NaNO2溶液、AgNO3溶液和稀硝酸,搅拌,充分反应后,过滤、洗涤沉淀;
ⅳ 干燥沉淀物,称得其质量为1.435g。
① 实验中发生的反应是 ,反应中AgNO3、NaNO2均需要过量的原因是 ;
② 实验测得火柴头中KClO3的质量分数为 ;
③ 如果第ⅱ步中未洗涤沉淀残渣,测得KClO3的质量分数将 (填“偏大”、“偏小”、或“无影响”,下同);如果第ⅲ步中未洗涤AgCl沉淀,测得KClO3的质量分数将 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com