
7.下列离子方程式书写正确的是 ( )
A.石英与烧碱溶液:SiO2+2OH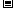 =SiO32
=SiO32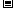 +H2O
+H2O
B.NH4HCO3和过量NaOH溶液相混合:HCO3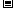 + OH
+ OH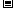 =CO32
=CO32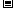 +H2O
+H2O
C.硫酸铜溶液与氢氧化钡溶液反应:Ba2+ +SO42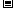 =BaSO4↓
=BaSO4↓
D.过量的NaHSO4和Ba(OH)2溶液。反应:H++SO42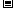 +Ba2++OH
+Ba2++OH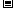 = BaSO4↓+H2O
= BaSO4↓+H2O
6.用括号中的试剂除去下列气体物质中所含杂质,所用药品正确的是 ( ) A.CO2中混有HCl(饱和Na2CO3溶液)
B.Cl2中混有HCl (AgNO3溶液)
C.H2S中混有H2O(g)(浓硫酸)
D.CO2中混有O2 (灼热的铜粉)
5.一定温度下在容积恒定的密闭容器中,进行如下可逆反应,A(s)+2B(g)  C(g)+D(g),当下列物理量不发生变化时,能表明该反应已达到平衡状态的是( )
C(g)+D(g),当下列物理量不发生变化时,能表明该反应已达到平衡状态的是( )
①混合气体的密度 ②容器内气体的压强 ③混合气体的总物质的量 ④B的物质的量浓度
A.①④ B.②③ C.②③④ D.只有④
4.某温度下,在体积一定的密闭容器中适量的NH3和Cl2恰好完全反应。若反应产物只有N2和NH4Cl固体,则反应前后容器中的压强比接近于 ( ) A.1:11 B.11:1 C.7:11 D.11:7
3.下列说法正确的是(用NA表示阿伏加德罗常数) ( )
A.H2O2是含有极性键的非极性分子
B.0.1mol NH4+ 所含电子的数目为NA
C.12C和14C和互为同素异形体
D.N2的化学性质不活泼说明氮元素的非金属性弱
2.下列说法正确的是 ( )
A.SiO2能溶于水,其溶液显酸性
B.将CO2通入水玻璃可得硅酸
C.已知高温时有:Na2CO3+SiO2 Na2SiO3
+CO2↑,所以硅酸的酸性比碳酸强
D.因为SiO2属于酸性氧化物,所以它不溶于任何酸
Na2SiO3
+CO2↑,所以硅酸的酸性比碳酸强
D.因为SiO2属于酸性氧化物,所以它不溶于任何酸
1.对于任何一个平衡体系,采取以下措施后,一定会使平衡移动的是 ( )
A.加入一种反应物 B.对平衡体系加压
C.升高温度 D.使用催化剂
33.(12分)已知乙烯能发生以下转化:
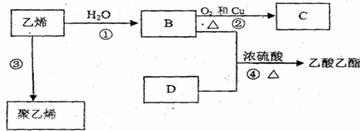
(1)乙烯的结构式为 ;反应②中的Cu的作用是
(2)写出化合物官能团的化学式及名称:
B中含官能团名称 ;D中含官能团名称 ;
(3)写出反应①~④的化学方程式、反应类型
反应①: 反应类型:
反应②: 反应类型:
反应③: 反应类型:
反应④: 反应类型:
(二)在海水提镁的流程图中如何实现对镁离子的分离?
(1)为了使镁离子沉淀下来,加入的足量试剂①是 (填化学式)。
(2)加入的足量试剂②是 (填化学式)。
(3)试从节约能源及提高金属镁纯度的角度分析,以下适宜的冶镁方法是 。

32.(9分)下图是元素周期表的一部分,表中的①~⑩各代表一种元素,用元素符号或化学式填空回答:
 族 族周期 |
IA |
IIA |
IIIA |
IVA |
VA |
VIA |
VIIA |
0 |
|
二 |
|
|
|
|
① |
|
② |
|
|
三 |
③ |
④ |
⑤ |
⑥ |
|
|
⑦ |
⑧ |
|
四 |
⑨ |
|
|
|
|
|
⑩ |
|
(1)在这些元素中,化学性质最不活泼的原子的结构示意图为 。
(2)地壳中含量最多的金属元素是 。(填元素符号)
(3)这些元素中的最高价氧化物对应的水化物中,酸性最强的物质是 ,碱性最强的物质是 ,呈两性的氢氧化物是 。(填化学式)
(4)写出⑤的单质与氢氧化钠溶液反应的化学方程式 。
写出⑤的氢氧化物与氢氧化钠溶液反应的离子方程式 。
(5)某元素R的气态氢化物为HXR,且R在该氢化物中的质量分数为94%,8.5g的HXR气体在标准状态下的体积是5.6L。则HXR的相对分子质量为 ;HXR的化学式为 。
(一)在海水提镁的过程中如何实现对镁离子的富集?
有三个学生提出自己的观点。
学生1的观点:直接往海水中加入沉淀剂。
学生2的观点:高温加热蒸发海水后,再加入沉淀剂。
学生3的观点:利用晒盐后的苦卤水,再加入沉淀剂。
请你评价三个学生提出的观点是否合便(填是或否),并简述理由。
|
|
是否合理 |
简述理由 |
|
学生1的观点 |
|
|
|
学生2的观点 |
|
|
|
学生3的观点 |
|
|
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com