
3.下列不随所取物质体积的多少而变化的量是
A.水的物质的量 B.某溶液的物质的量浓度
C.二氧化碳气体的质量 D.某氯化钠溶液中氯离子的数目
2.在工业制造硫酸的生产过程中,按反应先后顺序依次使用的主要设备是
A.沸腾炉、吸收塔、热交换器 B.热交换器、沸腾炉、接触室
C.沸腾炉、接触室、吸收塔 D、沸腾炉、吸收塔、接触室
1.吸入人体内的O2有2%转化为氧化性极强的活性氧如O3等。这些活性氧能加速人体衰老,被称为“夺命杀手”。我国科学家尝试用含硒化合物Na2SeO3消除人体内的活性氧,在此过程中Na2SeO3的作用是
A.还原剂 B.氧化剂
C.既是氧化剂,又是还原剂 D.以上均不是
24.(6分)将15g由NH4Cl和Ca(OH)2组成的混合物置于密闭容器中加热到250℃时,经充分反应,排出气体冷却后残留12g残渣,求原混合物中氮元素的质量可能是多少克?
23.(8分)氯化氢和氧气在一定条件下反应可得到氯气,现将氯化氢和氧气混合于一密闭容器中,在一定条件下使之反应,温度高于100℃,经过5min而达到平衡,经过测定物质的浓度分别为: (HCl) = 0.25mol/L,
(HCl) = 0.25mol/L, (O2) = 0.2mol/L,
(O2) = 0.2mol/L, (Cl2) = 0.1mol/L。则:
(Cl2) = 0.1mol/L。则:
(1)写出反应的方程式____________________________________________;
(2)开始时 (HCl) = _________________,
(HCl) = _________________, (O2) = ____________________;
(O2) = ____________________;
(3)从反应开始到反应平衡时,以HCl的浓度表示的化学反应速率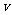 (HCl) = _________mol/(L·min),以HCl、O2、Cl2分别表示的反应速率的数值之比为__________;
(HCl) = _________mol/(L·min),以HCl、O2、Cl2分别表示的反应速率的数值之比为__________;
(4)反应后压强是反应前的_________倍。
22.(9分)如下图,向A中充入1 mol X、1 mol Y,向B中充入2 mol X、2 mol Y,起始时V(A)=V(B)= a L。反应开始时K关闭,在相同温度和有催化剂存在的条件下,两容器中各自发生反应:X(g)+Y(g)
 2 Z(g) +W(g)(正反应为放热反应)。(X、Y、Z、W均为气体),达到平衡,V(A)=1.2a L。
2 Z(g) +W(g)(正反应为放热反应)。(X、Y、Z、W均为气体),达到平衡,V(A)=1.2a L。

试回答:
(1)A容器中X的转化率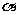 (A)=______________。
(A)=______________。
(2)A、B两容器中X的转化率的关系: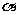 (A)________
(A)________ 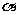 (B)。(填“>”、“<”或“=”)
(B)。(填“>”、“<”或“=”)
(3)打开K,一段时间后又达到平衡时,A的体积为________L。(连通管中气体体积不计)
(4)在第(3)问可逆反应达到化学平衡的基础上,同时等幅升高A、B的温度,达到新平衡后,A、B两容器内X气体的体积分数____________(填“变大”、“不变”或“变小”)。其理由是______________________________________________________________________。
21.(6分)将1mol I2 (g)和2 mol H2置于某容积为2 L的密闭容器中,在一定温度下发生反应:I2 (g)+H2
(g)  2HI(g)(该反应正反应放热),并达到平衡。HI的体积分数
2HI(g)(该反应正反应放热),并达到平衡。HI的体积分数 (HI)随时间的变化如图中曲线(Ⅰ)所示:
(HI)随时间的变化如图中曲线(Ⅰ)所示:

(1)达到平衡时,I2 (g)的物质的量浓度为_________mol/L。
(2)若改变反应条件,在甲条件下 (HI)的变化如图中曲线(Ⅱ)所示,则甲条件可能是______________ (填入下列条件的序号)
(HI)的变化如图中曲线(Ⅱ)所示,则甲条件可能是______________ (填入下列条件的序号)
①恒容条件下,升高温度 ②恒容条件下,减低温度
③恒温条件下,缩小反应容器的体积 ④恒温条件下,扩大反应容器的体积
⑤恒温恒容条件下,加入适当催化剂
(3)若保持容积稳定不变,在另一容积也为2 L的密闭容器中加入a mol I2 (g)、b mol H2和c mol HI(a、b、c均大于0),发生反应达到平衡时,HI的体积分数仍为0.60,则a、b、c的关系是___________________________。
20.(9分)下图中A-G均是中学化学常见的化合物,它们之间有如下图的转化关系(部分反应物或生成物略去),已知B为一种气体,E、F、G三种化合物中均含有一种元素M,且价态互不相同。请回答下列问题:

(1)M元素为(填元素符号)__________。
(2)B的化学式为 或 ,写出鉴别它们的两种试剂:__________ 和__________。
(3)若A与G反应也能制B,且反应中n(A)︰n(G)=1︰2,则此时该反应的离子方程式是:
__________________________________________。
(4)若B与F在一定条件下可反应生成一种化合物和一种气态单质,该反应的化学方程式为________________________________________。
19.(6分)在亚硝酸钠(NaNO2)中氮元素的化合价为+3价,为证明和研究亚硝酸钠的性质,现有下列几种试剂可供选择:
①KMnO4溶液,②稀H2SO4溶液,③稀HNO3溶液,④稀NaOH溶液,⑤淀粉、KI溶液,⑥品红溶液。(注:NaNO2的还原产物中氮元素的化合价一般为+2价)
试用上述试剂回答下列各问:
(1)证明NaNO2具有氧化性应选择的试剂是______,发生反应的离子方程式是____________。
(2)证明NaNO2具有还原性应选择的试剂是______,发生反应的离子方程式是____________。
18.(11分)氨气与灼热的氧化铜反应生成铜、氮气和水。利用如下图所示实验装置可测定氨分子的组成(图中夹持、固定装置均略去)。回答下列问题。

(1)写出氨气与氧化铜反应的化学方程式________________________________________。
(2)在干燥管B和D里应选用的干燥剂都是(填序号)_____________。
A.碱石灰 B.无水CuSO4 C.五氧化二磷 D.无水CaCl2
(3)在C的玻璃管中观察到的现象是______________________________________。
(4)E装置中盛装浓硫酸的目的是________________________________________。
(5)待实验完毕后,若实验测得N2的体积(折算成标准状况)为a L,则被还原的氧化铜的物质的量为________mol;若测得干燥管D增重b g,则氨分子中氮、氢的原子个数比为(用含a、b字母的代数式表示)________。
(6)上述实验中,如果省去B装置,测定氨分子组成的N、H原子个数的比值将会(填“增大”、“减小”或“无影响”)________,理由是____________________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com