
2.已知甲为恒温恒压容器,乙为恒温恒容容器。初始时,两容器的温度、体积相同,两容器中均充入2mol SO2和1mol O2,且发生反应 ;
;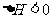 。当两容器都达到平衡后,为使两者中的SO2在平衡混合物中的物质的量分数相同,下列措施中肯定可行的是
。当两容器都达到平衡后,为使两者中的SO2在平衡混合物中的物质的量分数相同,下列措施中肯定可行的是
A.向甲容器中再充入一定量的氦气 B.适当降低乙容器的温度
C.向乙容器中再充入2mol SO3气体 D.缩小甲容器的体积
1.香皂一般呈碱性,长期用香皂洗脸容易造成面部油脂层破坏,皮肤老化;而洗面奶一般呈弱酸性,和皮肤酸碱性相似,有利于皮肤健康。市场上有一种“活性炭男士洗面奶”,据说是专门针对男士面部毛孔粗大容易吸纳污垢而开发的。此产品主要利用了活性炭
A.具有还原性 B.具有漂白性 C.具有吸附性 D.具有弱酸性
25.(8分)难溶化合物的饱和溶液存在着溶解平衡,例如:
 ,
, ,在一定温度下,难溶化合物得饱和溶液的离子浓度的乘积为一常数,这个常数用Ksp表示。
,在一定温度下,难溶化合物得饱和溶液的离子浓度的乘积为一常数,这个常数用Ksp表示。
已知: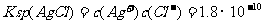
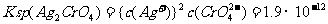
现有0.001mol/LAgNO3溶液滴定0.001mol/L KCl和0.001mol/L的K2CrO4的混和溶液,试通过计算回答:
(1)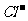 和
和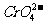 中哪种先沉淀?
中哪种先沉淀?
(2)当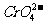 以Ag2CrO4形式沉淀时,溶液中的
以Ag2CrO4形式沉淀时,溶液中的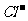 离子浓度是多少?
离子浓度是多少?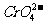 与
与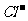 能否达到有效的分离?(设当一种离子开始沉淀,另一种离子浓度小于
能否达到有效的分离?(设当一种离子开始沉淀,另一种离子浓度小于 mol/L时,则认为可以达到有效分离)
mol/L时,则认为可以达到有效分离)
24.(10分)已知: 。分子式为C13H16O2的惕各酸苯乙酯广泛用于香精的调香剂。为了合成惕各酸苯乙酯,某实验室的科技人员用A[CH3CH2C(CH3)=CH2]及有关原料设计了下列合成路线:
。分子式为C13H16O2的惕各酸苯乙酯广泛用于香精的调香剂。为了合成惕各酸苯乙酯,某实验室的科技人员用A[CH3CH2C(CH3)=CH2]及有关原料设计了下列合成路线:
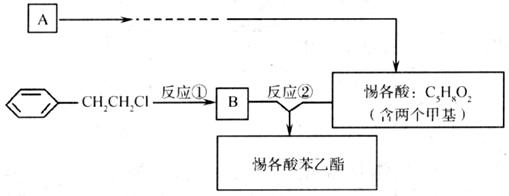
试回答下列问题:
(1)写出有关反应的化学方程式:
① ;
② 。
(2)为获取原料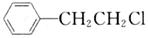 ,某同学提出两种可用途径:
,某同学提出两种可用途径:
Ⅰ.苯乙烷光照取代; Ⅱ.苯乙烯加成
试评价:哪种途径更合理?为什么? 。
(3)请你设计A→惕各酸的合成路线。
要求:①合成过程中无机试剂任选;②合成反应流程图表示方法示例如下:

23.(11分)亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖、油脂的漂白和杀菌,以下是用过氧化氢法生产亚氯酸钠的工艺流程图:
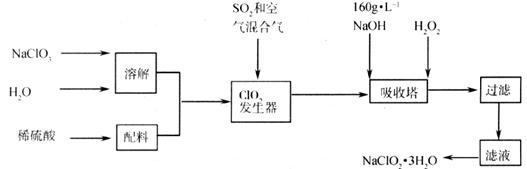
已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2·3H2O。
②纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下才安全。
(1)160g/LNaOH溶液的物质的量浓度为 。若要计算该溶液的质量分数,还需要的一个条件是 (用文字说明)。
(2)发生器中鼓入空气的作用可能是 (填序列号)
a.将SO2氧化成SO3,增强酸性 b.稀释ClO2以防止爆炸
C.将NaClO2氧化成ClO2
(3)吸收塔内的反应的化学方程式为 ,吸收塔的温度不能超过20℃,其目的是防止H2O2分解,写出H2O2分解的化学方程式: 。
(4)在碱性溶液中NaClO2比较稳定,所以吸收塔中应维持NaOH稍过量,判断NaOH是否过量的简单实验方法是 。
(5)吸收塔中为防止NalO2被还原成NaCl,所以还原剂的还原性应适中,除H2O2外,还可以选择的还原剂是 (填序列号)。
a.Na2O2 b.Na2S C.FeCl2 d.PbO
(6)从滤液中得到NaClO2·3H2O粗晶体的实验操作依次是 (填序列号)
a.蒸馏 b.蒸发 C.灼烧 d.过滤 e.冷却结晶
要得到更纯的NaClO2·3H2O晶体必须进行的操作是 (填操作名称)
22.(9分)中学化学中有很多物质可以实现如下图中物质之间的转化。其中反应条件和部分反应的产物已略去。
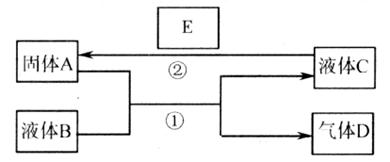
(1)若A是一种紫红色金属,气体D能使品红溶液褪色,加热时又可以恢复原色。写出反应①的化学方程式: ,气体D与另一种气体H混合后生成一种淡黄色固体W,写出该反应的化学方程式: ;
(2)若A是一种金属单质,D是最轻的气体,B能否是NaOH溶液? (填“能”或“否”)
(3)若A是金属单质,D是一种无色气体,遇到空气变为红棕色,液体C呈蓝色。写出反应①的离子方程式: ;写出反应②的离子方程式: ;
21.(7分)已知SO2(H2SO3)能使溴水褪色,且相互定量反应。简答用惰性电极电解物质的量浓度相等的BaI2和SO2的混合液(含少量的淀粉)时的现象和反应问题:
(1)电解时,在阳极附近的溶液中,将先后观察到什么现象?请写出先后相应发生的两步阳极反应式。
(2)写出第二步电解的化学方程式: 。
(3)如此分步电解的理论根据是什么? 。
20.(11分)元素周期表是学习化学的重要工具,它包含了许多信息和规律。下表所列是五种短周期元素的原子半径及主要化合价:
|
元素代号 |
A |
B |
C |
D |
E |
|
原子半径/nm |
0.16 |
0.143 |
0.102 |
0.089 |
0.074 |
|
主要化合价 |
+2 |
+3 |
+6,-2 |
+2 |
-2 |
(1)用元素代号标出它们在周期表中对应位置
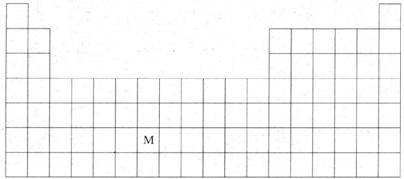
(2)C、E形成化合物为 (填化学式),周期表有些元素存在“对角线相似”现象,请写出D的单质与强碱溶液反应的离子方程式: ;并用电子式表示其氯化物的形成过程 。
(3)有一类无机化合反应的通式可以表示为:单质+化合物(1)=化合物(2)。请写出满足以下要求的4个此类无机化合反应的化学方程式:
①所涉及的元素的原子序数都小于30,②4种单质分属4个不同族。
___ , ,
___ , 。
(4)M为金属元素铼(Re),铼是自然界中最后一种被诺达克等三位科学家于1926年发现的元素。他们从数以吨计的含有多种元素的矿石中,通过复杂的工艺一点一滴地富集浓缩,才制得了仅2mg的金属铼。现代工业上采用的方法是:于800℃的高温下,在氢气流中使高铼酸钾中的铼元素全部被还原出来。
①元素铼的原子序数为 ,铼元素发现如此艰难和时间上如此漫长的原因: 。
②写出现代工业上用氢气冶炼金属铼的化学方程式,并标出电子转移的方向和数目: 。
19.(8分)50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如下图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
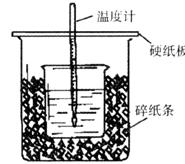
(1)从实验装置上看,图中尚缺少的一种玻璃用品是 。
(2)烧杯间填满碎纸条的作用是 。
(3)大烧杯上如不盖硬纸板,求得的中和热数值 (填“偏大”、“偏小”或“无影响”)。
(4)实验中60mL0.50mol/L盐酸与50mL0.55mol/L NaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等”或“不相等”),所求中和热 (填“相等”或“不相等”),简述理由: 。
(5)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会 (均填“偏大”、“偏小”或“无影响”);用50mL0.50mol/LNaOH溶液进行上述实验,测得的中和热的数值会 (均填“偏大”、“偏小”或“无影响”)。
18.现有一瓶失去标签的纯净的铵盐,为测定其中的含氮量可以采用“甲醛法”,即: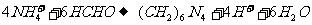 。现在称取2g该铵盐溶于水,加入足量的甲醛溶液后,再加水配成100mL溶液,取出10mL该溶液,滴入酚酞后再逐滴滴入0.1mol/L的NaOH溶液,当滴到25mL时溶液变成粉红色,则该铵盐中氮的质量分数是
。现在称取2g该铵盐溶于水,加入足量的甲醛溶液后,再加水配成100mL溶液,取出10mL该溶液,滴入酚酞后再逐滴滴入0.1mol/L的NaOH溶液,当滴到25mL时溶液变成粉红色,则该铵盐中氮的质量分数是
A.17.5% B.17.7% C.21.2% D.35%
第Ⅱ卷(非选择题 共64分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com