
22.(15分)2007年元月,在湖北发生了一起危险化学品泄漏事故,造成上百人中毒,1人死亡。有机物a是一种重要的化工原料,在有机合成中可用于代替卤代烷作为甲基化剂,在化工、医药、农药、军工、染料、香料、橡胶、皮革等工业中都有着广泛的应用。现有一种有机香料A是经过有机物a作为甲基化剂(提供甲氧基:-OCH3)合成的。有关性质如下左图所示:

(1)在物质结构图(如上右图)中,●表原子序数从1到10的元素的原子实(原子实是原子除去最外层电子后剩余的部分),小黑点代表未用于形成共价键的最外层电子,短线代表价键(示例 )据a的结构特点可推知a的分子式为 ,水解产物的分子式为 。
)据a的结构特点可推知a的分子式为 ,水解产物的分子式为 。
(2)A分子中的官能团的名称是 。
(3)根据以上信息写出A可能的结构简式 。
(4)A可以发生的反应有 (填写序号字母)。
a.还原反应 b.氧化反应 C.酯化反应 d.水解反应
(5)同时符合下列四个要求的有机物A的同分异构体共有 种。
①含有苯环;
②能发生银镜反应,不能发生水解反应;
③1mol该同分异构体能与2 mol Na发生反应;
④苯环上只能生成3种一氯代物
(6)写出B→C的化学方程式(有机物用结构简式表示):
21.(6分)现有两个反应(反应所需的其他条件和各物质的化学计量数均已略去):
①A+B→M+D+E;②M+E→A+F+B。请针对以下两种不同情况来完成试题要求。
(1)若A是一种日常生活中用作调味剂的盐,反应①是化学工业上制取单质E和化合物M的重要方法。则A的电子式为 ;反应②的离子方程式为 ;在酸性条件下,若将化合物F加到含Fe2+的溶液中,溶液从浅绿色变成黄色,该反应的离子方程式为 。
(2)若A是一种含氧酸盐,可用于实验室中检验水的存在。1个A的阴离子中共含有50个电子,其中含有一种元素X,X的原子最外层电子数是电子层数的2倍,则X在元素周期表中的位置是 。X单质的熔点是112.8℃,则X单质属于 晶体(填晶体类型)。
(3)若A是(2)中的含氧酸盐,当以石墨作电极电解A溶液时,电流为 A,
A,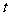 min后阴极增重
min后阴极增重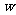 g,在阳极得到VL(标准状况)纯净气体,则阿伏加德罗常数NA的计算式是(1个电子的电荷量为
g,在阳极得到VL(标准状况)纯净气体,则阿伏加德罗常数NA的计算式是(1个电子的电荷量为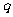 C) 。
C) 。
20.(6分)“绿色奥运”是北京2008奥运会的三大主题之一,使用清洁能源、防治交通污染、改善空气质量加速建设污水处理和回收工程、防止固体废弃物污染、植树造林、促进生态良性循环等,是北京实现“绿色奥运”的主要工作。北京申奥时向国际奥委会承诺:位于北京城西的首都钢铁公司在2008年前迁出。
(1)首钢为什么会对北京市区环境造成污染?
(2)其主要的大气污染物各是怎样形成的(写出必要的化学方程式)?
(3)请用化学方程式表示其中任意一种污染物对北京造成的危害。
19.(8分)对于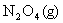

 ,在温度一定时,平衡体系中NO2的体积分数
,在温度一定时,平衡体系中NO2的体积分数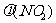 随压强的变化情况如下图所示(实线上的任何一点为对应压强下的平衡点)。
随压强的变化情况如下图所示(实线上的任何一点为对应压强下的平衡点)。

(1)A、C两点的正反应速率的关系为 (填“<”“>”或“=”)。
(填“<”“>”或“=”)。
(2)A、B、C、D、E各状态中, 的是 。
的是 。
(3)维持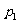 不变,E→A所需时间为
不变,E→A所需时间为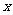 ;维持
;维持 不变,D→C所需时间为
不变,D→C所需时间为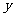 ,则
,则 (填“<”“>”或“=”)。
(填“<”“>”或“=”)。
(4)欲要求使E状态从水平方向到达C状态后,再沿平衡曲线到达A状态,从理论上来讲,可选用的方法是 。
A.从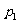 无限缓慢加压至
无限缓慢加压至 ,再由
,再由 无限缓慢降压至
无限缓慢降压至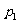
B.从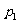 突然加压至
突然加压至 ,再由
,再由 无限缓慢降压至
无限缓慢降压至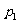
C.从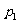 突然加压至
突然加压至 ,再由
,再由 突然降压至
突然降压至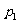
D.从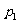 无限缓慢加压至
无限缓慢加压至 ,再由
,再由 突然降压至
突然降压至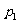
18.室温下,下列溶液等体积混合后,所得溶液的pH一定大于7的是
A.0.1mol/L的盐酸和0.1mol/L的NaOH溶液
B.0.1mol/L的盐酸和0.1mol/L的Ba(OH)2溶液
C.pH=4的醋酸溶液和pH=10的NaOH溶液
D.pH=4的盐酸和pH=10的氨水
第Ⅱ卷(非选择题 共64分)
17.某500mL溶液中含0.1molFe2+、0.2molFe3+,加人0.2mol铁粉,待Fe3+完全还原后,溶液中Fe2+的物质的量浓度为(假设反应前后体积不变)
A.0.4mol/L B.0.6mol/L C.0.8mol/L D.1.0mol/L
16.若以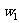 和
和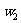 分别表示浓度为
分别表示浓度为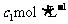 和
和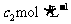 硫酸的质量分数,且知
硫酸的质量分数,且知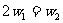 ,则下列推断正确的是(硫酸的质量分数越大,密度越大)
,则下列推断正确的是(硫酸的质量分数越大,密度越大)
A. B.
B. C.
C.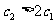 D.
D.
15.在露天广场的晚会现场常常看到小朋友手持被称为“魔棒”的荧光棒玩耍。“魔棒”发光原理是利用过氧化氢氧化草酸二酯产生能量,该能量被传递给荧光物质后便发出荧光。草酸二酯(CPPO)结构简式为:
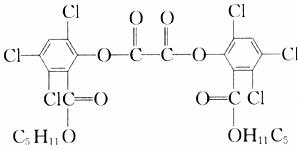
下列有关说法正确的是
A.草酸二酯属于芳香族化合物
B.草酸二酯属于高分子化合物
C.1mol草酸二酯与氢氧化钠稀溶液反应(苯环上卤素不水解),最多消耗4mol NaOH
D.1mol草酸二酯与氢气完全反应,需要氢气10mol
14.把A、B、C、D四种物质放在密闭容器中,在一定条件下充分反应,并测得反应物和产物在反应前后各物质的质量如下表所示:
|
物质 |
A |
B |
C |
D |
|
反应前的质量/g |
19.7 |
8.7 |
21.6 |
0.4 |
|
反应后的质量/g |
待测 |
17.4 |
0 |
3.6 |
下列说法正确的是
A.物质C一定是化合物,物质D可能是单质
B.反应后密闭容器中A的质量为19.7g
C.单位时间内,物质B和物质D变化的质量比为87︰36
D.若物质A与物质C的相对分子质量之比为194︰116,则反应中A和C的化学计量数之比为1︰2
13.A元素的原子最外层电子数是 ,次外层电子数是
,次外层电子数是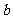 ;B元素的原子M层电子数是
;B元素的原子M层电子数是 ,L层电子数是
,L层电子数是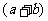 ,则A、B两种元素形成的化合物的化学式可以表示为
,则A、B两种元素形成的化合物的化学式可以表示为
A.B3A2 B.BA2 C.A3B2 D.AB2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com