
3.下列化合物属于弱电解质的是
A.HCIO4 B.BaSO3 C.CO2 D.HF
2. 设反应C+CO2  2CO(正反应吸热)反应速率为v1,N2+3H2
2CO(正反应吸热)反应速率为v1,N2+3H2  2NH3(正反应放热),反应速率为v2。对于上述反应,当温度升高时,v1、v2的变化情况为
2NH3(正反应放热),反应速率为v2。对于上述反应,当温度升高时,v1、v2的变化情况为
A.同时增大 B.同时减小 C.v1增大,v2减小 D.v1减小,v2增大
1.胡椒粉是植物挥发油的成分之一。它的结构式为HO- -CH2CH=CH2,下列叙述中不正确的是
-CH2CH=CH2,下列叙述中不正确的是
A.1mol胡椒粉最多可与4mol氢气发生反应
B.1mol胡椒粉最多可与4mol溴发生反应
C.胡椒粉可与甲酸发生反应,生成聚合物
D.胡椒粉在水中的溶解度小于苯酚在水中的溶解度
32.取一定量的Na2CO3、NaHCO3和Na2SO4的混合物与250mL1.00mol·L-1过量盐酸反应,生成2.016CO2(标准状况),然后加入500mL0.100mol·L-1Ba(OH)2溶液,得到沉淀的质量为2.33g,溶液中过量的碱用10.0mL 1.00mol·L-1盐酸恰好完全中和。试求各物质的质量。
31.(1)①某同学判断SO2和Na2O2反应能生成硫酸钠,你认为他的判断合理吗? 。
若合理,请写出可能有的反应方程式: 。(若不合理,此空不用填)
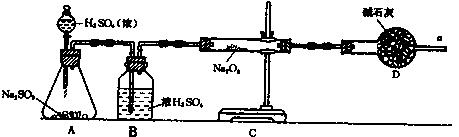
②该同学无法断定SO2和Na2O2反应中是否有氧气生成,拟使用上面装置进行实验。装置中B的作用是 ,D的作用是 。
③为确认是否有氧气生成,该同学用带火星的细木条靠的干燥管口a,观察细木条是否复燃,若木条复燃,则认为有氧气生成,若木条不复燃,则认为过程中无氧气生成,你认为他的判断合理吗? 。
(2)为了探究过氧化钠和二氧化硫反应的产物,某课外活动小组的同学进一步设计了如图所示的装置:
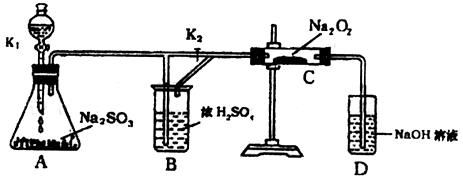
①甲同学先打开活塞K2,再打开活塞K1,几分钟后,发现C管内固体变白色,且经检验D中出来的气体有O2。从而得出结论:SO2和CO2相似,跟过氧化钠反应产物为Na2SO3和O2,试分析甲同这结论是否正确?为什么?
②乙同学认为产物应该有Na2SO4,故重新添加C中药品,然后关闭活塞K2,打开活塞K1。为检验是否有Na2SO4生成,他们设计了如下方案
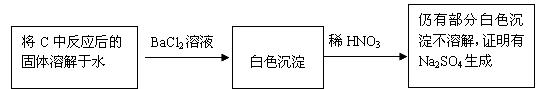
试回答:
上述方案是否合理? 。请简要说明两点理由: ;
。
30.(9分)图中的每一方格表示有关的一种反应物或生成物,其中A、B、C为无色气体,I为无色液体。请填下列空白:
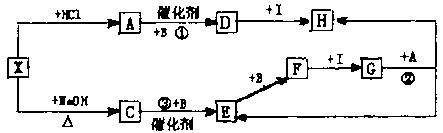
(1)物质D是 ,C是 ,F是 。
(2)反应③的化学方程式是 。
(3)反应②的离子方程式是 。
(4)30mLF和O2的混合气体溶于足量水后,气体体积变为5mL,则F和O2的体积比可能为 。
A.2:1 B.9:1 C.1:2 D.3:4
29.(9分)有A、B、C、D、E五种短周期元素,它们的原子序数由A到E依次增大,已知A是原子半径最小的元素,B原子的核外电子总数为其电子层数的3倍,C和E同主族,C和D形成的离子化合物D2C中所有离子的电子数相同且其电子总数为30,试根据以上叙述回答:
(1)BC2的结构式为 ,该分子为 (填“极性分子”或“非极性分子”)
(2)C、D、E离子半径由大到小的顺序为 (用具体的离子符号表示)
(3)酸化的KMnO4溶液中滴入A2C2溶液,KMnO4溶液褪色,若MnO-4被还原为Mn2+,请完成相应的离子方程式:
(4)由A、C、D、E四种元素形成的两种物质在溶液中发生反应的离子方程式为:
(5)现有ag A2、BC、BA4混合物在氧气中不断用电火花点燃,将得到的产物通入足量的Na2O2中,充分反应后Na2O2增重的质量wg范围为
28.(11分)
(1)配平化学方程式,回答问题
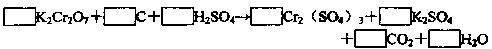
其中氧化剂是 ,氧化产物与还原产物的物质的量之比是 。
(2)已知下列变化过程中,有0.2molRxO2-4参加反应,转移0.4mol电子。
①配平该离子反应式: RxO2-4+ MnO-4+ H+-- RO2+ Mn2++ H2O;
②推算出x值为 ;
③反应中的还原剂为 ;
④在上述变化过程中,参加反应的H+的物质的量为 mol。
27.(13分)
(1)某混合气体中可能含有N2、O2、Cl2、HCl、NH3、NO、NO2中的两种或多种气体,现将此无色透明的混合气体通过浓硫酸后,气体体积明显减小,当剩余气体与空气接触时,立即变为红棕色,则原混合气体中一定含有的气体是 ,一定不存在的气体是 ,可能存在的气体是 。
(2)将等物质的量的Cl2和SO2气体通入滴有石蕊试液的BaCl2溶液中,出现的现象是
,用化学方程式简述产生此现象的原因:
。
Cl2和SO2气体都具有一定的漂白性,如何用实验方法证明它们的漂白原理的不同
。
26.(14分)元素周期表是学习化学的重要工具,它包含了许多的信息和规律。下表是元素周期表的一部分,请从下表①~⑨九种元素中选择适当的元素回答下列问题:
 |
IA |
IIA |
IIIA |
IVA |
VA |
VIA |
VIIA |
|
1 |
① |
|
|||||
|
2 |
|
|
|
② |
③ |
④ |
|
|
3 |
⑤ |
|
⑥ |
⑦ |
|
⑧ |
⑨ |
(1)元素⑧的原子结构示意图为 ,表中元素形成的碱性最强的碱为 ,酸性最强的含氧酸为 。(用相应的化学式表示)
(2)表中元素形成的四核10电子阳离子的化学式为 ,形成的四核18电子分子的电子式为 。
(3)元素⑤氢氧化物溶液与元素⑥的氧化物反应的离子方程式 。
工业上制取元素⑦的单质的化学方程式为 。
(4)某元素原子的次外层为2个电子,其最高正价与最低价负价的代数和为2,则该元素的名称是 。另有一元素,其原子的核外电子数等于电子层数。这两种元素可以形成多种化合物,其中有一种离子化合物A中两元素的原子个数比为1:5,它的所有原子的最外层都符合相应稀有气体原子的最外层电子结构。写出A的电子式 。A物质与水反应生成一种碱和无色气体,写出有关的化学方程式
,该反应中的还原剂为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com