
13.下列离子方程式书写正确的是
A.过量的SO2通入NaOH溶液中:SO2+2OH- = SO32 -+H2O
B.Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I- = 2Fe2++I2
C.NaNO2溶液中加入酸性KMnO4溶液:2MnO4- +5NO2- +6H+ = 2Mn2++5NO3- +3H2O
D.NaHCO3溶液中加入过量的Ba(OH)2溶液:2HCO3- +Ba2++2OH- = BaCO3↓+2H2O+CO32 -
12. 可逆反应2SO2(g) + O2(g) ⇌ 2SO3 (g) 从正方向开始,并达到了平衡。此时SO2和O2的物质的量之比为2∶1;若采取某种措施,导致SO2和O2又消耗了一些,并再次达到平衡,下列说法正确的是
A.新平衡体系中,SO2和O2物质的量之比仍为2∶1
B.平衡向正反应方向移动了,原因是正反应速率增大了,逆反应速率减小了
C.新平衡体系与旧平衡体系比较,SO3的浓度肯定增大了
D.若所采取的措施是缩小容器的容积,则新平衡SO2和O2转化率之比和旧平衡中SO2和O2的转化率之比都是1∶1
11.下列有关强电解质叙述正确的是
A.离子化合物一般是强电解质
B.强电解质在熔化状态下一定能够导电
C.具有强极性键的共价化合物可能是强电解质
D.强电解质的水溶液一定具有很强的导电能力
10.恒温下的甲乙两密闭容器,甲体积不变,乙容器带有理想活塞,体积可变,两容器的起始状态完全相同,都充有C气体。发生反应C(g) 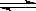 A(g)+B(g),一段时间后,容器中的反应均达到平衡。下列说法正确的是
A(g)+B(g),一段时间后,容器中的反应均达到平衡。下列说法正确的是
A.平均反应速率:乙>甲 B.到达平衡时C的物质的量:乙>甲
C.到达平衡时C的转化率:乙>甲 D.到达平衡时A的物质的量:甲>乙
9.有等体积等pH的Ba(OH)2、NaOH和NH3·H2O三种碱溶液,滴加等浓度的盐酸将它
们恰好中和,用去酸的体积分别为V1、V2、V3,则三者的大小关系正确的是
A.V3>V2>V1 B.V3=V2=V1 C.V3>V2=V1 D.V1=V2>V3
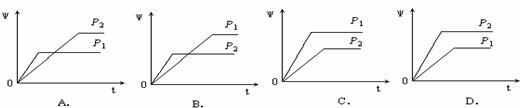
8.在一定温度不同压强(P1<P2)下,可逆反应2X(g) 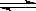 2Y(g) + Z(g)中,生成物Z在反应混合物中的体积分数(ψ)与反应时间(t)的关系有以下图示,正确的是
2Y(g) + Z(g)中,生成物Z在反应混合物中的体积分数(ψ)与反应时间(t)的关系有以下图示,正确的是
7.广义的水解观认为:无论是盐的水解还是非盐的水解,其最终结果是反应中各物质和水分别离解成两部分,然后两两重新组合成新的物质。根据上述观点,说法不正确的是
A.BaO2的水解产物是Ba(OH)2和H2O2 B.PCl3的水解产物是HClO和H3PO3
C.A14C3的水解产物是Al(OH)3和CH4 D.CH3COCl的水解产物是两种酸
6.下列关于原电池的叙述错误的是
A.原电池中的电解质不一定处于液态
B. 若欲使原电池处于工作状态,必须将其与外电路形成闭合回路
C. 排在金属活动性顺序表前面的金属总是作负极,排在后面的金属总是作正极
D. 负极总是发生氧化反应,正极总是发生还原反应
5.用pH试纸测定溶液pH的正确操作是
A.将一小块试纸放在表面皿上,用玻璃棒蘸取少量待测液点在试纸上,再与标准比色卡对照
B.将一小块试纸用蒸馏水润湿后放在表面皿上,用玻璃棒蘸取少量待测点在试纸上,再与标准比色卡对照
C.将一小条试纸在待测液中蘸一下,取出后放在表面皿上,与标准比色卡对照
D.将一小条试纸先用蒸馏水润湿后,在待测液中蘸一下,取出后与标准比色卡对照
4.“中和热”是一个在热化学中的重要概念,“中和热”的定义为:在稀溶液中,酸跟碱发生中和反应则生成1mol H2O,这时的反应热叫做中和热。以下关于中和热的叙述正确的是
A.在稀溶液中所有酸和碱反应的中和热数值都相等
B.在稀溶液中强酸与强碱反应的中和热都相等
C.在稀溶液中1mol强酸和1mol强碱反应放出的热量都相等
D.将浓硫酸滴入氢氧化钠溶液中刚好生成1mol水时,产生的热量即为中和热
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com