
23.(10分)一定条件下,在体积为3 L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g) CH3OH(g)
CH3OH(g)
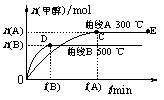
根据题意完成下列各题:
(1)反应达到平衡时,平衡常数表达式K= ,升高温度,K值 (填“增大”、“减小”或“不变”)。
(2)在500 ℃,从反应开始到平衡,氢气的平均反应速率v (H2)= 。
(3)在其他条件不变的情况下,对处于E点的体系体积压缩到原来的1/2,下列有关该体系的说法正确的是
a.氢气的浓度减少 b.正反应速率加快,逆反应速率也加快
c.甲醇的物质的量增加 d.重新平衡时n(H2)/n(CH3OH)增大
(4)据研究,反应过程中起催化作用的为Cu2O,反应体系中含少量CO2有利于维持催化剂Cu2O的量不变,原因是:_______________________________________(用化学方程式表示)。
22.(10分)工业上制备BaCl2的工艺流程图如下:
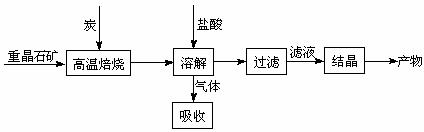
某研究小组在实验室用重晶石(主要成分BaSO4)对工业过程进行模拟实验。查表得
BaSO4(s) + 4C(s) 4CO(g) +
BaS(s) △H1 = 571.2 kJ·mol-1 ①
4CO(g) +
BaS(s) △H1 = 571.2 kJ·mol-1 ①
BaSO4(s) + 2C(s) 2CO2(g)
+ BaS(s) △H2= 226.2 kJ·mol-1 ②
2CO2(g)
+ BaS(s) △H2= 226.2 kJ·mol-1 ②
⑴气体用过量NaOH溶液吸收,得到硫化钠。Na2S水解的离子方程式为 。
⑵向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时,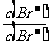 =
。
=
。
[Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10]
⑶反应C(s) + CO2(g) 2CO(g)的△H2= kJ·mol-1。
2CO(g)的△H2= kJ·mol-1。
⑷实际生产中必须加入过量的炭,同时还要通入空气,其目的是
, 。
21.(12分)明矾石是制取钾肥和氢氧化铝的重要原料,明矾石的组成和明矾相似,此外还含有氧化铝和少量氧化铁杂质。具体实验步骤如下图所示:
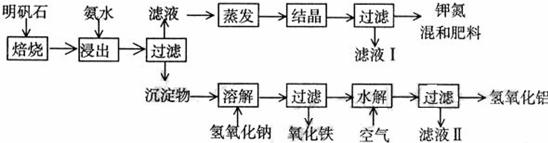
根据上述图示,完成下列天空:
⑴ 明矾石焙烧后用稀氨水浸出。配制500mL稀氨水(每升含有39.20g氨)需要取浓氨水(每升含有250.28g氨) mL,用规格为 mL量筒量取。
⑵ 氨水浸出后得到固液混合体系,过滤,滤液中除K+、SO42-外,还有大量的NH4+。检验NH4+的方法是 。
⑶ 写出沉淀物中所有物质的化学式 。
⑷ 滤液I的成分是水和 。
⑸ 为测定混合肥料K2SO4、(NH4)2SO4中钾的含量,完善下列步骤:
①称取钾氮肥试样并溶于水,加入足量 溶液,产生白色沉淀。
② 、 、 (依次填写实验操作名称)。
③冷却、称重。
⑹ 若试样为mg,沉淀的物质的量为nmol,则试样中K2SO4的物质的量为:
mol(用含m、n的代数式表示)。
20.(10分)某校化学研究性学习小组设计实验验证Fe、Cu的金属活动性,他们提出了以下两种方案。请你帮助他们完成有关实验项目:
方案Ⅰ:有人提出将大小相等的铁片和铜片,分别同时放入稀H2SO4(或稀盐酸)中,观察产生气泡的快慢,据此确定它们的活动性。该原理的离子方程式为 。
方案Ⅱ:有人利用Fe、Cu作电极设计成原电池,以确定它们的活动性。试在下面的方框内画出原电池装置图,标出原电池的电极材料和电解质溶液,并写出现象及电极反应式。

正极现象: 正极反应式: ;
负极现象: 负极反应式: 。
结合你所学的知识,帮助他们再设计一个验证Fe、Cu活动性的简单实验方案(与方案Ⅰ、Ⅱ不能雷同): ,用离子方程式表示其反应原理: 。
19.(4分)⑴ 下图为常见仪器的部分结构(有的仪器被放大)
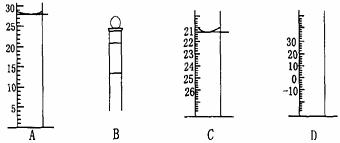
图A中液面所示溶液的体积为 mL,用上述四种仪器中的某种测量一液体的体积,平视时读数为n mL,仰视时读数为m mL,若m>n,则所使用的仪器是 (填字母标号)。
⑵ 有一支50ml酸式滴定管,其中盛有溶液,液面恰好在10.00ml刻度处。把滴定管中的溶液全部排出,承接在量筒中,量筒内溶液的体积:
A.大于40.00ml B.为40.00ml C.小于40.00ml D.为10.00ml
⑶ 某同学的实验报告中有如下数据,其中数据合理的是:
A.用托盘天平称取3.25gNaCl B.用酸式滴定管量取20.00mLKMnO4溶液
C.用量筒量取5.26mL盐酸 D.用容量瓶配制216mL0.1mol/L的NaOH溶液
E.用广泛pH试纸测得某酸溶液的pH值是3.3
18.某学生设计了一个“黑笔写红字”的趣味实验。滤纸先用氯化钠、无色酚酞的混合液浸湿,然后平铺在一块铂片上,接通电源后,用铅笔在滤纸上写字,会出现红色字迹。据此,下列叙述正确的是
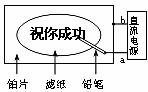
A.铅笔端作阳极,发生还原反应 B.铂片端作阴极,发生氧化反应
C.铅笔端有少量的氯气产生 D.a点是负极,b点是正极
第二卷 非选择题(共87分)
17.下列溶液中各微粒的浓度关系不正确的是
A.0.1 mol·L-1 HCOOH溶液中:c(HCOO-)+c(OH-) = c(H+)
B.1 L 0.1 mol·L-1 CuSO4·(NH4)2SO4·6H2O的溶液中:c(SO42 -)>c(NH4+ ))>c(Cu2+)>c(H+)>c(OH-)
C.0.1 mol·L-1 NaHCO3溶液中:c(Na+)+c(H+)+c(H2CO3) = c(HCO3- )+c(CO32 -)+c(OH-)
D.等体积、等物质的量浓度的NaX和弱酸HX混合后的溶液中:c(Na+)>c(HX)>c(X-)>c(H+)>c(OH-)
16.下列事实一定能说明HF是弱酸的是
①常温下,0.1mol/L的HF溶液和0.1mol/L的醋酸溶液中和NaOH的能力相同
②用HF溶液做导电性实验,灯泡很暗
③常温下,0.1mol/L的HF溶液中加入少量NaF晶体的pH发生变化
④常温下0.1mol/L的HF溶液的pH为2.3
⑤常温下,pH=2的HF溶液和HCl溶液都稀释100倍时,HCl溶液pH值变化大
⑥1mol/L的NaF水溶液能呈碱性
A.①②③④⑤⑥ B.②③④⑤⑥ C.②③④⑥ D.③④⑤⑥
15.室温时,下列混合溶液的pH一定小于7的是
A.pH = 3的盐酸和pH = 11的氨水等体积混合
B.pH = 2的盐酸和pH = 11的氢氧化钡溶液等体积混合
C.pH = 3的醋酸和pH = 11的氢氧化钡溶液等体积混合
D.pH = 3的硫酸和pH = 11的氨水等体积混合
14.氯气溶于水达到平衡后,若其他条件不变,只改变某一条件,下列叙述正确的是
A.再通入少量氯气,c(H+)/c(ClO-)减小
B.通入少量SO2,溶液漂白性增强
C.加入少量固体NaOH,一定有c(Na+)=c(Cl-)+c(ClO-)
D.加入少量水,水的电离平衡向正反应方向移动
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com