
3.下列实验中,仪器的下端必须插入液面下的是 ( )
①制备氢气的简易装置中的长颈漏斗;
②制备氯气装置中的分液漏斗;
③制备Fe(OH)2操作中的胶头滴管;
④将氨气气体溶于水的导管;
⑤用乙醇制取乙烯时的温度计;
⑥分馏石油时的温度计;
A.①③④⑤ B.②④⑥ C.①③⑤ D.全部
2.下列实验操作中,一般情况下不应该相互接触的是 ( )
A.用胶头滴管向试管中滴液体时,滴管尖端与试管内壁
B.向容量瓶中转移液体时,使用的玻璃棒与容量瓶颈内壁
C.用滴定管向锥形瓶内注入一定体积的待测溶液时,滴定管的尖嘴与锥形瓶内壁
D.实验室将HCl气体溶于水时,漏斗口与水面
1.下列实验中①配制一定物质的量浓度的溶液 ②pH试纸的使用 ③过滤 ④蒸发,均可用到的仪器是 ( )
A.试管 B.漏斗 C.胶头滴管 D.玻璃棒
23.(12分)图中电极a.b分别为Ag电极和Pt电极,电极c.d都是石墨电极。通电一段时间后,a.b两极上无气体,在c.d两极上共收集到336 mL(标准状况)气体。回答:
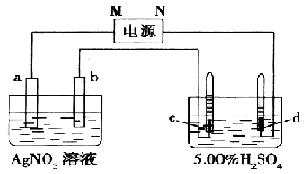
(1)直流电源中,M为 极。
(2)Pt电极上生成的物质是 ,其质量为 g。
(3)电源输出的电子,其物质的量与电极b.c.d上分别生成的物质的量之比为:2: : : 。
(4)AgNO3溶液的浓度 ,AgNO3溶液的pH ,H2SO4溶液的浓度 ,H2SO4溶液的pH 。(均填“增大”.“减小”或“不变”)
(5)若H2SO4溶液的质量分数由5.00%变为5.02%,则原有5.00%的H2SO4溶液质量为 g。
22.(10分)有机化合物A的分子式是C13H20O8(相对分子质量为304),1 mol A在酸性条件下水解得到4 mol CH3COOH和1 mol B。B分子结构中每一个连有羟基的碳原子上还连有两个氢原子。
请回答下列问题:
(1)A与B的相对分子质量之差是 。
(2)B的结构简式是: 。
(3)B不能发生的反应是 (填写序号)。
①氧化反应 ②取代反应 ③消去反应 ④加聚反应
(4)已知:
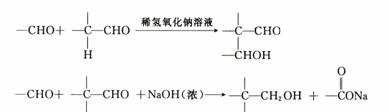
以两种一元醛(其物质的量之比为1:4)和必要的无机试剂为原料合成B,写出合成B 的各步反应的化学方程式。
21.(15分)Ⅰ.某研究性学习小组的同学设计右图所示实验装置制得纯净的Fe(OH)2白色沉淀。已知两极材料分别为石墨和铁:
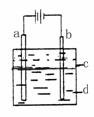
(1)b极材料为 。
(2)电解液d可以是下列物质中的 (填字母代号)
A.纯水 B.NaCl溶液 C.NaOH溶液 D.CuCl2溶液
(3)液体c为苯,其作用是 ,在加苯之前对d溶液进行加热煮沸处理,目的是 。
(4)写出a.b两电极上的电极反应式a极: .b极: 。
Ⅱ.草酸晶体(H2C2O4·2H2O)受热易分解(分解温度为175℃),产生CO和CO2。
(1)写出草酸晶体受热分解的化学方程式: 。
(2)将a g草酸晶体加热至完全分解时,所得气体的平均相对分子质量为 。
(3)实验可用图装置将CO2和CO进行分离和干燥。已知a.b均为活塞,试回答:①甲瓶中应装 溶液,乙瓶中装的是 ,分液漏斗中应装 。
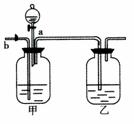
②当CO2和CO混合气体通过该装置时,先分离得到的气体是 ,活塞操作顺序是:关闭 ,打开 。
20.(9分)A、B、C、D都是短周期主族元素,原子序数依次增大,A的核电荷数大于2,可形成氢化物H2A,该氢化物在常温下是液体。B的阴离子与C的阳离子跟氖原子的电子层结构相同。D和A两元素可形成D2A3化合物,该化合物既能溶于强酸又能溶于强碱。试回答下列问题:
(1)C在A2中燃烧生成淡黄色固体Y。Y的电子式为: 。Y的晶体是 晶体,晶体中阳离子与阴离子的个数比为 。
(2)C和B的氢化物的水溶液反应可放出一种无色气体,请写出该反应的离子方程式:
。
(3)若D和Mg与NaOH溶液构成原电池,写出该原电池的负极反应式:
。
(4)B、C、D可组成离子化合物CxDB6,其晶胞(晶胞是在晶体中具有代表性的最小重复单元)结构如图所示,阳离子C+(用○表示)位于正方体的棱的中点和正方体内部;阴离子DB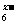 用●表示)位于该正方体的顶点和面心,该化合物的化学式是 。
用●表示)位于该正方体的顶点和面心,该化合物的化学式是 。
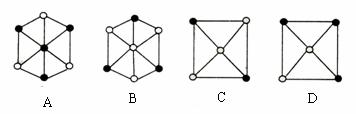
(5)如图A、B、C、D是其晶胞的1/8沿体对角线方向在纸平面上的投影,其中能正确反映微粒位置关系的是 。
19.(10分)(1)化学上常用的除杂或提纯的方法有: ①溶解过滤;②蒸发结晶;③冷却结晶;④加热(或灼烧);⑤蒸馏(或分馏);⑥洗气;⑦盐析;⑧渗析;⑨萃取分液;⑩升华等,欲除去下列各组混合物中的杂质,(括号中为杂质),请选择合适的主要方法,将其序号填写在相应的空白处:
A.Na2CO3(BaCO3) B.CaO(CaCO3)
C.NaCl(NH4Cl) D.KCl(KNO3)
E.蛋白质[(NH4)2SO4] F.CO2(SO2)
G.苯(甲苯) H.水(碘)
(2)下列有关实验操作会导致所测结果偏大的是
①在测定硫酸铜晶体里结晶水含量的实验中,加热时有少量晶体溅出坩埚;
②在测定硫酸铜晶体里结晶水含量的实验中,当蓝色晶体完全变成白色粉末且不再有水蒸气逸出后,熄灭酒精灯,待坩埚在泥三角上自然冷却后再称量;
③在中和热的测定实验中,将盐酸与氢氧化钠溶液混合后,没有迅速盖上盖板并及时搅拌;
④在中和热的测定实验中,用浓硫酸代替了等体积的稀盐酸;
⑤在用标准盐酸滴定某氢氧化钠溶液测定其物质的量浓度的实验中,用酚酞作指示剂;
⑥在用标准盐酸滴定某氢氧化钠溶液测定其物质的量浓度的实验中,所取出的氢氧化钠溶液在空气中露置时间过长。
18.以惰性电极电解一定浓度的CuSO4溶液,通电一段时间后,向所得的溶液中加入0.1 mol Cu(OH)2,恰好恢复到电解前的pH和浓度,则电解过程中转移的电子的物质的量为、
A.0.1 mol B.0.2 mol C.0.3 mol D.0.4 mol
第II卷(非选择题 共56分)
17.X、Y、Z为短周期主族元素,X原子的最外层电子数是Y原子最外层电子数的2倍,Y的原子序数比X的原子序数多5,Z原子的最外层电子数比Y原子最外层电子数多3。下列叙述正确的是( )
A.原子半径的大小顺序:Z>Y>X
B.Z单质与X单质直接反应可生成两种化合物
C.工业上,电解X和Y形成的化合物制取Y单质
D.Y、Z元素的最高价氧化物对应的水化物不能互相反应
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com