
15.根据下表信息,下列叙述中正确的是
|
序号 |
氧化剂 |
还原剂 |
其他反应物 |
氧化产物 |
还原产物 |
|
① |
Cl2 |
FeBr2 |
|
|
Cl- |
|
② |
KMnO4 |
H2O2 |
H2SO4 |
O2 |
Mn2+ |
|
③ |
KClO3 |
浓盐酸 |
|
Cl2 |
|
|
④ |
KMnO4 |
浓盐酸 |
|
Cl2 |
Mn2+ |
A.表中①组反应的氧化产物只能有FeCl3
B.氧化性强弱比较:KMnO4>Fe3+>Cl2>Fe2+
C.④的离子方程式配平后,H+的化学计量数为16
D.表中③还原产物是KCl
14.某无色溶液中只可能含有①Na+ 、②Ba2 +、 ③Cl一、 ④Br一、⑤SO32一、⑥SO42一 离子中的若干种,依次进行下列实验,且每步所加试剂均过量,观察到的现象如下。
|
步骤 |
操作 |
现象 |
|
(1) |
用pH试纸检验 |
溶液的pH大于7 |
|
(2) |
向溶液中滴加氯水,再加入CCl4振荡,静置 |
CCl4层呈橙色 |
|
(3) |
向所得水溶液中加入Ba(NO3)2溶液和稀HNO3 |
有白色沉淀产生 |
|
(4) |
过滤,向滤液中加入AgNO3溶液和稀HNO3 |
有白色沉淀产生 |
下列结论正确的是
A.肯定含有的离子是①④⑤ B.肯定没有的离子是②⑤
C.可能含有的离子是①⑥ D.不能确定的离子是③⑥
13.对于平衡体系:aA(g)+bB(g)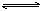 cC(g)+dD(g);正反应放热,有下列判断,其中正确的是
cC(g)+dD(g);正反应放热,有下列判断,其中正确的是
A.若从正反应开始,平衡时,A、B的转化率相等,则起始时A、B物质的量之比为a:b
B.若温度不变,容器体积缩小一半,平衡时A的浓度是原来的1.8倍,则a+b小于c+d
C.若平衡体系中共有气体m mol,再向其中充入n molB,达到平衡时气体总物质的量为(m+n)mol,则a+b=c+d
D.若a+b=c+d ,则对于体积不变的容器,升高温度,平衡向左移动,容器中气体的压强不变
12.在两个密闭容器中,分别充有质量相同的甲、乙两种气体,若两容器的温度和压强
均相同,且甲的密度大于乙的密度,则下列说法正确的是:
A.甲的分子数比乙的分子数少 B. 甲的摩尔体积比乙的摩尔体积小
C.甲的物质的量比乙的物质的量多 D.甲的相对分子质量比乙的相对分子质量小
11. A是一种常见的单质,B、C为中学常见的化合物,A、B、C均含有元素X。它们有如下的转化关系(部分产物及反应条件已略去):A 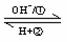 B+C,下列判断正确的是
B+C,下列判断正确的是
A.X元素可能为金属元素 B.X元素一定为非金属元素
C.反应①、②一定为氧化还原反应 D.反应①和②互为可逆反应
10.某学生设计了一个“黑笔写红字”的趣味实验。滤纸先用氯化钠、无色酚酞的混合液浸湿,然后平铺在一块铂片(接电源b极)上,接通电源后,用铅笔(接电源a极)在滤纸上写字,会出现红色字迹。据此,下列叙述正确的是

A.铅笔端作阳极,发生还原反应 B.铂片端作阴极,发生氧化反应
C.a点是负极,b点是正极 D.铅笔端有少量的氯气产生
9.在一定条件下,可逆反应:N2+3H2 2NH3,DH<0,达到平衡时,当单独改变下列条件后,有关叙述错误的是
2NH3,DH<0,达到平衡时,当单独改变下列条件后,有关叙述错误的是
A.加催化剂V正、V逆都发生变化且变化的倍数相等
B.降温,V正、V逆都减小,且V逆减小倍数大于V正减小倍数
C.加压,V正、V逆都增大,且V正增大倍数大于V逆增大倍数
D.体积不变加入氩气,V正、V逆都增大,且V正增大倍数等于V逆增大倍数
8.目前,人类已经发现的非金属元素除稀有气体元素外有16种,下列对这16种非金属、元素的判断不正确的是
①原子的最外层电子数均大于3;
②单质在反应中都只能作氧化剂;
③对应的含氧酸都是强酸;
④氢化物常温下都是气态,所以又叫气态氢化物。
A.只有①② B.只有①②③ C.全部 D.只有①②④
7.在烧杯甲中放入20g Na2O2,在烧杯乙中放入20g氢氧化钡与氯化铵的混合物,分别加入20mL水,搅拌,使它们溶解,然后把盛有少量乙醚液体的试管浸入烧杯甲的溶液中,用明火接近试管口,能产生黄色火焰,再把此试管浸入烧杯乙的溶液中,发现黄色火焰由长变短,直至熄灭。上述两实验可说明的是
①乙醚可燃 ②乙醚的沸点较低
③氢氧化钡与氯化铵混合能吸收大量热 ④Na2O2溶于水能放出大量的热
A.①②③ B.①③④ C.②③④ D.①②③④
5.下列离子方程式正确的是
A.在硫酸铜溶液中加入过量氢氧化钡溶液:Ba2++SO42-=BaSO4↓
B.碳酸氢钠溶液与少量石灰水反应:2HCO3-+Ca2++2OH-=CaCO3↓+CO32-+2H2O
C.向氯化铝溶液中加入过量氨水:A13++4NH3·H2O A1O2-+4NH4++2H2O
A1O2-+4NH4++2H2O
D.NH4HCO3溶液与过量NaOH溶液混合后加热:NH4++OH-=NH3↑+H2O
|
① 酸性氧化物在一定条件下均能与碱发生反应② 弱酸与盐溶液反应可以生成强酸,
③ 发生复分解反应,但产物既没有水生成,也没有沉淀和气体生成,
④ 两种酸溶液充分反应后,所得溶液呈中性,
⑤ 有单质参加的反应,但该反应不是氧化还原反应,
⑥ 两种氧化物发生反应有气体生成
A.①②③④⑤⑥ B.②④⑤⑥ C.①②③⑤ D.③④⑤⑥
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com