
9. 本题列举的四个选项是4位同学在探究学习“化学反应速率和化学平衡”一章后,联系工业生产实际所发表的观点,你认为不正确的( )
A、化学反应速率理论是研究怎样在一定时间内快出产品
B、化学平衡理论是研究怎样使用有限原料多出产品
C、化学反应速率理论是研究怎样提高原料转化率
D、平衡移动原理不能用来判断建立新平衡所需要的时间
8. NA表示阿伏加德罗常数的值,下列说法正确的是( )
A、常温常压下,32 g O2和O3的混合气体所含原子数为2 NA
B、1 mol Cl2参加氧化还原反应,转移的电子数目一定是2 NA
C、1 L 1 mol/L H3PO4 溶液中含有的H+的个数为3NA
D、20℃、1.01×105 Pa时,2.24 L NH3和CO的混合气体,含气体分子数为0.1 NA
7.能正确表示下列反应的离子方程式是( )
A、铁跟盐酸反应:2Fe + 6H+ = 2Fe3+ + 3H2↑
B、磷酸二氢钙溶液跟氢氧化钙溶液反应:H2PO4- +2OH- = PO43- +2H2O
C、碳酸钙跟醋酸反应:CaCO3 + 2CH3COOH = Ca2++2CH3COO- +H2O + CO2↑
D、铜片跟稀硝酸反应:Cu + NO3- + 4H+ = Cu2+ + NO↑+2H2O
6.已知三角锥形分子E和直线形分子G反应,生成两种直线形分子L和M(组成E、G、L、M分子的元素原子序数均小于10)如下图,则下列判断错误的是( )
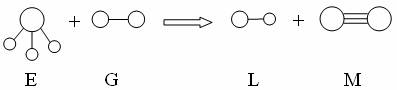
A、G是最活泼的非金属单质 B、L是极性分子
C、E能使紫色石蕊试液变蓝色 D、M化学性质活泼
5.对于某些离子的检验及结论一定正确的是( )
A、加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32¯
B、加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42¯
C、加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,一定有NH4+
D、加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+
4. 下列物质存放方法正确的是( )
A.Na、K存放在盛煤油的细口瓶中
B.实验室中盛放碱溶液的试剂瓶要用橡胶塞或软木塞
C.少量白磷可保存在CS2中
D.HNO3溶液和HF溶液均要保存在棕色玻璃瓶中
3.砷(As)元素的原子序数为33,下列关于砷元素的叙述不正确的是( )
A、最高价氧化物的化学式为As2O5
B、其气态氢化物的稳定性强于磷化氢而弱于硫化氢
C、砷单质在通常状况下为固态
D、砷酸是一种弱酸,酸性比磷酸酸性弱
2.科学家已成功合成了少量N4,有关N4的说法正确的是( )
A、N4是N2的同素异形体 B、N4是N2的同位素
C、相同质量的N4和N2所含原子个数比为1:2 D、N4的摩尔质量是56g
1.“神舟飞船”的运载火箭的推进剂引燃后,产生大量高温气体从尾部喷出,该气体主要成分是CO2、H2O、N2、NO等,在发射现场可看到火箭尾部产生大量桔红色气体,其原因是( )
A、高温下N2遇空气生成NO2 B、NO遇空气生成NO2
C、CO2与NO反应生成CO和NO2 D、NO与H2O反应生成H2和NO2
26. (14分)
(1)I.短周期某主族元素M的电离能情况如下图(A)所示。则M元素位于周期表的第 族。

II.图B折线c可以表达出第 族元素氢化物的沸点的变化规律。两位同学对某主族元素氢化物的沸点的变化趋势画出了两条折线a和b,你认为正确的是: (填“a”或“b”);
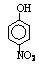
部分有机物的熔沸点见下表:
|
烃 |
CH4 |
CH3CH3 |
CH3(CH2)2CH3 |
硝基苯酚 |
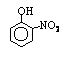 |
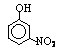 |
 |
|
沸点/℃ |
-164 |
-88.6 |
-0.5 |
熔点/℃ |
45 |
96 |
114 |
由这些数据你能得出的结论是(至少写2条): ,
。
(2)COCl2俗称光气,分子中C原子采取 杂化成键;其中碳氧原子之间共价键含有 (填字母):a.2个σ键;b.2个π键;c.1个σ键、1个π键。
(3)金属是钛(22Ti) 将是继铜、铁、铝之后人类广泛使用的第四种金属,试回答:
I.Ti元素的基态原子的价电子层排布式为 ;
II.已知Ti3+可形成配位数为6的配合物。现有紫色和绿色两种含钛晶体,其组成均为TiCl3·6H2O。为测定这两种晶体的化学式,设计了如下实验:a.分别取等质量的两种晶体的样品配成溶液;b.向两种溶液中分别滴入AgNO3溶液,均产生白色沉淀;c.沉淀完全后分别过滤得两份沉淀,经洗涤干燥后称量发现:其沉淀质量:绿色晶体为紫色晶体的2/3。则绿色晶体配合物的化学式为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com