
2.由解放军总医院研制的小分子团水(航天员专用、pH略大于7)具有在人体内储留时间长、排放量少的特点。关于小分子团水的说法不正确的是 ( )
A.小分子团水中水分子的化学性质没有改变
B.小分子团水中水分子内的氢、氧原子间的平均距离减小
C.小分子团水中水分子间范德华力增大
D.小分子团水中由水电离出的c(H+)、c(OH-)相等
1.澳大利亚研究人员最近开发出被称为第五形态的固体碳,这种新的碳结构称作“纳米泡沫”, 它外形类似海绵,比重极小,并具有磁性。纳米泡沫碳与金刚石的关系是( )
A.同系物 B.同分异构体 C.同位素 D.同素异形体
29.(17分)某研究性学习小组欲测定某绿色粉末Cu2(OH)2CO3·xH2O中的x值,并进行相关实验探究。
已知:Cu2(OH)2CO3·xH2O固体在加热条件下发生反应;
Cu2(OH)2CO3·xH2O 2CuO+CO2↑+(x+1)H2O
2CuO+CO2↑+(x+1)H2O
(Mr[Cu2(OH)2CO3·xH2O]=222; Mr(CuO)=80;Mr(CO2)=44;Mr(H2O)=18)
[实验一]测定Cu2(OH)2CO3·xH2O中的x值。
(1)准确称取m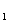 g。该粉末样品,置于坩埚中,用酒精灯缓慢加热至完全分解,冷却,
g。该粉末样品,置于坩埚中,用酒精灯缓慢加热至完全分解,冷却,
称得剩余固体的质量为m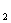 g。加热粉末时,除了坩埚、坩埚钳、三角架、玻璃棒、酒精灯外还要用到的仪器是 ,操作中需要用玻璃棒轻轻搅拌固体,目的是
g。加热粉末时,除了坩埚、坩埚钳、三角架、玻璃棒、酒精灯外还要用到的仪器是 ,操作中需要用玻璃棒轻轻搅拌固体,目的是
所测得的x值为_ (用含m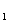 、m
、m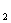 的代数式表示)。
的代数式表示)。
(2)下列是甲、乙两位同学对实验过程中绿色粉末是否已完全分解的判断依据。
甲:观察到粉末变成黑色,不再有水蒸气逸出。
乙:重复加热、冷却、称量,至恒重(两次称量的质量差不超过0.1g)。
你认为其中合理的是 (填“甲”或“乙”)。
(3)测定x值还有其它方法。下列是几位同学在实验设计中拟测定的数据,其中无法计
算得出x值的是 (填序号)。
① 只测定生成物CO2、CuO的质量
② 只测定生成物CO2、H2O的质量
③ 只测定反应物Cu2(OH)2CO3·xH2O和生成物CO2的质量
④ 只测定反应物Cu2(OH)2CO3·xH2O和生成物H2O的质量
「实验二]利用上述反应的分解产物氧化铜氧化乙醇制备乙醛(沸点为20.8℃)。
(1)用如图所示装置(图中夹持装置已略去)进行实验时,需要加热的仪器是 (填标号)。B装置中收集到的物质有 。
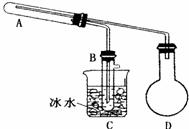
(2)能证明氧化铜氧化乙醇的实验现象是 试管A内发生反应的化学方程式为 。
28.(16分)在磷的催化作用下,羧酸可以和卤素反应生成a-卤代酸,例如:
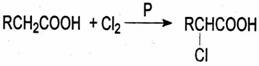
根据以下各步反应的条件和最终产物的分子式,试
(1) 推断物质A、C、F、H的结构简式。

A_______________ C_______________ F_______________ H_______________
(2) 写出D与Ag(NH3)2OH溶液反应的化学方程式
_________________________________________________________________________
(3)近年来,化石燃料短缺,价格上涨,世界各国都在积极寻求替代品。在上述A~H化合物中,最适合用作燃料的是__________(填结构简式),理由____________________
27.(13分)A-J分别表示中学化学中常见的一种物质,它们之间的相互转化关系如下图所示(部分反应物、生成物没有列出),且已知G为主族元素的固态氧化物(常温下),A、B、C、D、E、F六种物质中均含同一种元素。请填写下列空白:
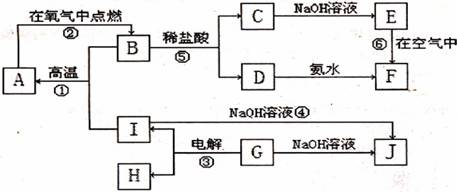
(1)G物质的化学式是_____________________。
(2)写出反应⑤的化学方程式________________________________________。
反应④的离子方程式___________________________________________。
(3)反应①-⑥中,不属于氧化还原反应的是__________________________。(填序号)
(4)从能量变化的角度看,①②③反应中属于放热反应是________________。(填序号)
26.(14分)A、B、C、D、E为五种短周期元素,他们的原子序数依次增大,其中A与D、C与E分别是同主族元素,只有D元素的单质是金属,D是短周期元素中原子半径最大的元素,E元素的原子最外层电子数是次外层电子数的四分之三,B的核内质子数等于C原子的最外层电子数。据此回答:
(1)E在周期表的位置 ;
(2)由A、C、D三种元素形成的一种化合物中所含化学键类型是 ;
(3)写出BC2的电子式 ;其固态时的晶体类型是 ;
已知由A、B、C三种元素组成的一种化合物是人体所需能量的重要来源之一,18g该固体化合物在人体中完全氧化时所产生的热量为280KJ,请写出其热化学方程式 ;
13.设NA表示阿伏加德罗常数,下列说法中正确的是 ( )
A.1mol甲基正离子(CH3+)所含电子数为8NA
B.NA个H2分子的质量约为2g,它所占的体积约为22.4L
C.标准状况下,11.2L CHCl3中所含的分子数为0.5NA
D.500mL 0.5mol/L的Ca(ClO)2溶液中,含有ClO-的数目为0.5NA
第Ⅱ卷 非选择题(共174分)
12.向淀粉中加入少量稀硫酸后再加热,使其发生水解,为判定水解发生程度,应选择下列试剂中的 ( )
①NaOH溶液 ②银氨溶液 ③新制Cu(OH)2悬浊液 ④碘水 ⑤BaCl2溶液
A.①③④ B.②④或③④ C.①②⑤ D.②④⑤
11. 在一密闭容器进行反应:2SO2(g) + O2(g) 2SO3(g)。已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2mol/L、0.1mol/L、0.2mol/L。当反应达平衡时,可能存在的数据是 ( )
在一密闭容器进行反应:2SO2(g) + O2(g) 2SO3(g)。已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2mol/L、0.1mol/L、0.2mol/L。当反应达平衡时,可能存在的数据是 ( )
A.SO2为0.4mol/L,O2为0.2mol/L B.SO2为0.25mol/L
C.SO2、SO3均为0.15mol/L D.SO3为0.4mol/L
10.用惰性电极电解硫酸铜和盐酸的混合溶液,则阴、阳两极产生的气体成分及体积比不可能是 ( )
A.阳极为纯净气体,阴、阳两极产生的气体体积比≤1∶1
B.阳极为纯净气体,阴、阳两极产生的气体体积比≥1∶1
C.阳极为混合气体,阴、阳两极产生的气体体积比≤1∶1
D.阳极为混合气体,阴、阳两极产生的气体体积比≥1∶1
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com