
22.(12分)工业制硫酸生产流程如下图:

(1)我国黄铁矿资源比较丰富,但很多工厂仍以硫磺为原料生产硫酸,理由是
?
(2)在催化反应室,下列措施中有利于提高SO2平衡转化率的有 ;
A.升高温度 B.减少压强
C.不断补充空气 D.及时分离出SO3
(3)在生产中为提高催化剂催化效率采取了哪些措施? ?(至少答出两点措施)
(4)已知2SO2(g)+O2(g) 2SO3(g),ΔH=-196 kJ·mol-1。在450℃、常压和钒催化条件下向一密闭容器中充入2molSO2和1molO2,充分反应后,放出的热量______(填“<”“>”“=”)196kJ,理由是_____________________________________。
2SO3(g),ΔH=-196 kJ·mol-1。在450℃、常压和钒催化条件下向一密闭容器中充入2molSO2和1molO2,充分反应后,放出的热量______(填“<”“>”“=”)196kJ,理由是_____________________________________。
(5)经检测生产硫酸的原料气成分(体积分数)为SO27%、O211%、N282%。在 500℃,0.1MPa条件下达到平衡时,各种气体的体积比为V(SO2):V(SO3):V(O2):V(N2)=0.46:6.54:7.73:82,则SO2的利用率为 。
21.(9分) A、B、C、D是四种短周期元素,它们的原子序数依次增大,其中A与C,B与D分别是同主族元素;已知B、D二元素原子核中质子数之和是A、C二元素原子核中质子数之和的2倍;四种元素形成的单质中有两种是气体;两种是固体。
试回答:
(1)写出由B、C二元素所形成的原子个数比为1∶1的化合物的电子式__________,其晶体中存在的化学键有____________________(填化学键名称)。
(2)写出均由A、B、C、D四种元素组成的两种化合物的水溶液发生反应的离子方程式为:____________________ 。
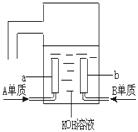
(3)用A元素的单质与B元素的单质可制成新型的化学电源,已经在宇宙飞船中使用。其构造如图所示。两个电极均由多孔性碳制成,通入的气体由孔隙中逸出,并在电极表面放电。则a是 ___极,电极反应式为______ 。
20.(8分)甲酸(HCOOH)是一种有刺激臭味的无色液体,有很强的腐蚀性。熔点8.4℃,沸点100.7℃,能与水、乙醇互溶,加热至160℃即分解生成二氧化碳和氢气。
(1)实验室可用甲酸与浓硫酸共热制备一氧化碳:HCOOH浓硫酸========H2O+CO↑,实验的部分装置如下图所示。制备时先加热浓硫酸至80℃-90℃,再逐滴滴入甲酸。
①从下图挑选所需的仪器,画出Ⅰ中所缺的气体发生装置(添加必要的塞子、玻璃管、胶皮管,固定装置不用画),并标明容器中的试剂。
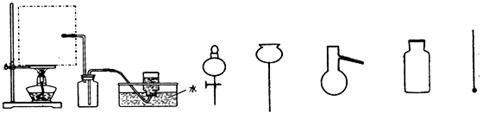
Ⅰ制备CO Ⅱ Ⅲ收集CO 分液漏斗 长颈漏斗 蒸馏烧瓶 集气瓶 温度计
②装置Ⅱ的作用是 。
(2)实验室可用甲酸制备甲酸铜。其方法是先用硫酸铜和碳酸氢钠作用制得碱式碳酸铜,然后再与甲酸制得四水甲酸铜[Cu(HCOO)2·4H2O]晶体。相关的化学方程式是:
2CuSO4+4 NaHCO3== Cu(OH)2·CuCO3↓+3CO2↑+2Na2SO4+H2O
Cu(OH)2·CuCO3+4HCOOH+ 5H2O==2 Cu(HCOO)2·4H2O+ CO2↑
实验步骤如下:
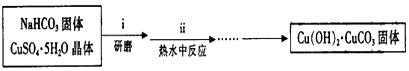
①碱式碳酸铜的制备:
a、步骤ⅰ是将一定量CuSO4·5H2O晶体和NaHCO3固体一起放到研钵中研磨,其目的是 。
b、步骤ⅱ是在搅拌下将固体混合物分多次缓慢加入热水中,反应温度控制在
70℃-80℃,如果看到 (填写实验现象),说明温度过高。
② 甲酸铜的制备:
将Cu(OH)2·CuCO3固体放入烧杯中,加入一定量热的蒸馏水,再逐滴加入甲酸至碱式碳酸铜恰好全部溶解,趁热过滤除去少量不溶性杂质。在通风橱中蒸发滤液至原体积的1/3时,冷却析出晶体,过滤,再用少量无水乙醇洗涤晶体2-3次,晾干,得到产品。
a、“趁热过滤”中,必须“趁热”的原因是 。
b、用乙醇洗涤晶体的目的是 。
19.(4分)下列有关实验的叙述中,正确的是 (填序号)。
①将浓氨水逐滴滴入装有生石灰的烧瓶中,可以制取氨气。
②取1mL 20%蔗糖溶液,加入适量稀硫酸,水浴加热约5min后,再加入少量新制的Cu(OH)2,加热,可检验蔗糖是否发生水解。
③配制一定物质的量浓度的NaCl溶液时,定容后摇匀,发现液面又低于刻度线,此时须再加入蒸馏水至刻线。
④用小刀切取少量金属钠做实验,切剩的钠要立即放入原试剂瓶。
⑤分液漏斗分液时,先将下层的液体从下口流出,然后再从下口流出上层的液体
⑥测定某溶液pH时,取一小块干燥的试纸放入玻璃片上,用玻璃棒蘸取溶液滴在试纸的中部,再与标准比色卡对比
⑦配制氯化铁溶液时,先将氯化铁固体加入盐酸中溶解,然后加水稀释;
⑧向100℃时的NaOH稀溶液中滴加饱和的FeCl3溶液,以制备Fe(OH)3胶体;
⑨向试管中滴加液体时,为不使液体滴到试管外应将胶头滴管伸入试管中;
⑩配置100 mL 1.00mol/L的NaCl溶液时,可用托盘天平称取5.85 gNaCl固体。
18.2008年北京奥运会主体育场的外形好似“鸟巢”。有一类硼烷也好似鸟巢,故称为巢式硼烷。巢式硼烷除B10H14不与水反应外,其余均易与水反应生成氢气和硼烷。硼烷易被氧化。下图是三种巢式硼烷,有关说法正确的是 ( )
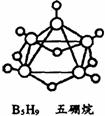

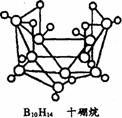
A.硼烷与水反应是非氧化还原反应
B.2B5H9+12O2=5B2O3+9H2O,1mol B5H9完全燃烧转移48mol电子
C.8个硼原子的巢式硼烷的化学式一定为B8H10
D.这类巢式硼烷的通式可能是:BnHn+4
|
17.常温下,下列有关叙述不正确的是 ( )
A.足量铁屑溶于稀硝酸所得溶液中:c(NO3-)>c(Fe2+)>c(H+)>c(OH-)
B.pH相同的CH3COONa溶液、C6H5ONa溶液、Na2CO3溶液、NaHCO3溶液:
c(CH3COONa)>c(NaHCO3) >c(C6H5ONa ) >c(Na2CO3 )
C.已知酸性HF>CH3COOH,物质的量浓度相等的NaF与CH3COOK溶液中:
[c(Na+)-c(F-)] < [c(K+)-c(CH3COO-)]
D.10 mL pH=12的NaOH aq中加入pH=2的HB溶液至pH刚好等于7,所得溶液体积V(总)≥20 mL
16.如图所示的装置,C、D、E、F、X、Y都是惰性电极。将电源接通后,向(乙)中滴入酚酞溶液,在F极附近显红色。则以下说法正确的是 ( )
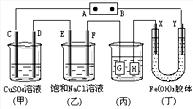
A.电源B极是正极
B.(甲)、(乙)装置的C、D、E、F电极均有单质生成,其物质的量之比为1∶2∶2∶2
C.欲用(丙)装置给铜镀银,H应该是Ag,电镀液是AgNO3溶液
D.装置(丁)中X极附近红褐色变浅,说明氢氧化铁胶粒带负电荷
15. 常温下,向20L真空容器中通入a mol H2S和b mol Cl2(a、b均为正整数,且a≤5,b≤5),反应完成后,容器内气体可能达到的最大密度是 ( )
A.17.85 g·L-1 B.18.00 g·L-1
C.18.25 g·L-1 D.18.50 g·L-1
14.镁及其化合物一般无毒(或低毒)、无污染,镁电池放电时电压高且平稳,因而越来越成为人们研制绿色电池所关注的重点。有一种镁二次电池的反应为
 :xMg+Mo3S4 MgxMo3S4 ;下列说法中错误的是 ( )
:xMg+Mo3S4 MgxMo3S4 ;下列说法中错误的是 ( )
A.放电时Mg2+ 向正极迁移
B.放电时正极的电极反应为 Mo3S4 + 2xe- == Mo3S42x-
C.放电时 Mo3S4 发生氧化反应
D.充电时阴极的电极反应为 x Mg2+ + 2xe- == xMg
13.在浓盐酸中H3AsO3与SnCl2反应的离子方程式为:3SnCl2+12Cl-+aH3AsO3+bH+=aAs+3SnCl62-+cM。关于该反应的说法中正确的组合是( )
① 氧化剂是H3AsO3; ② 还原性:Cl->As;
③ 每生成24gAs,还原剂失去的电子为0.96mol;
④ M为OH-; ⑤ a=2,b=6。
A.①③⑤ B.①②④⑤ C.①②③④ D.只有①③
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com