
1.核内质子数不同,核外电子数相同的两种微粒,它们可能是
A.同种元素的两种离子 B.同种元素的原子和离子
C.不同元素的离子 D.不同元素的原子
32.(共6分)向20mL 0.2mol/LNaOH溶液中缓缓通入一定量的CO2气体,将溶液在低温条件下蒸干,若得到的白色固体是纯净物,则通入CO2的体积应为 ml(标况),有关离子方程式为 。将上述白色固体加水溶解,加盐酸至PH=7再蒸干得白色固体质量为 g。
31.(13分 )如图,在一个小烧杯里,加入20g Ba(OH)2·8H2O粉末,将小烧杯放在事先已滴有3-4滴水的玻璃片上,然后加入10g NH4Cl晶体,并用玻璃棒迅速搅拌。
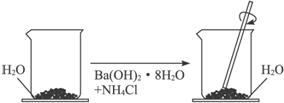
(1)实验中玻璃棒搅拌的作用是 。
(2)写出有关反应的化学方程式 ,
该反应属于 反应。(填四个基本反应中的一个)
(3)实验中观察到的现象有 和反应混合物成糊状。反应混合物呈糊状的原因是 。
如果实验中没有看到“结冰”现象,可能的原因是__________________________。
(4)通过 现象,说明该反应为 热反应。
30.(4分)实验室用98%的浓硫酸(密度为1.84g/mL)配制1.5mol/L稀硫酸溶液200ml。回答下列问题:
(1)现有量筒、酸式滴定管、玻璃棒、烧杯,还缺少 。
(2)稀释浓硫酸的方法是 。
29.(10分)某无色溶液,其中有可能存在的离子如下:Na+、Ag+、Fe3+、Ba2+、Al3+、
AlO2-、S2-、SO32-、SO42-,现取该溶液进行有关实验,实验结如下:

(1)生成沉淀甲的离子方程式为 。
(2)由溶液甲生成沉淀乙的离子方程式为 。
(3)沉淀丙可能是 (填化学式)。
(4)气体甲的成分有哪几种可能,答:① ② ③ (有多少种就填多少种,可不填满)
(5)综合上述信息,可以肯定存在的离子有 。
28.(8分):在酸性条件下,将含MnO4- 、Fe2+、Fe3+ 、I- 四种离子的溶液混在一起,充分反应后,若:
(1)溶液中I- 有剩余,则溶液中可能还有_______ __,一定没有________ _ _ 。
(2)溶液中Fe3+ 有剩余,则溶液中可能还有_____ ___,一定没有_______ ___ 。
(3)溶液中Fe2+ 有剩余,则溶液中可能还有___ ____,一定没有_____ ___ 。
(4)溶液中MnO4- 有剩余,则溶液中可能还有_ _,一定没有______ 。
27.(7分):
(1)配平下列离子反应方程式:
Fe(OH)3+ ClO-+ OH- -- FeO4n-+ Cl-+ H2O
(2)已知有3.21gFe(OH)3参加反应,共转移了5.4×1022个电子,则n= ,FeO4n-中铁元素的化合价为 。
(3)根据(1)、(2)推测,FeO4n-能和下列 (填序号)物质反应。
A.KMnO4 B.SO2 C.H2S D.O2
26.某稀溶液中含有Fe(NO3)3、Cu(NO3)2、HNO3,向其中逐渐加入铁粉,溶液中Fe2+的浓度(纵坐标/mol·L-1)和加入铁粉的物质的量(横坐标/mol)之间的关系如图所示。则溶液中Fe(NO3)3、Cu(NO3)2、HNO3物质的量浓度之比为 ( )

A.1∶1∶1 B.1∶3∶1
C.3∶3∶8 D.1∶1∶4
Ⅱ卷(共48分)
|
25.在标准状况下,将5.6 L CO2气体与250 mL 1 mol/L NaOH溶液充分反应,所得溶液pH=8.3,下列关系式中正确的是: ( )
A.c(Na+)>c(HCO-3)>c(OH-)>c(H+)
B. c(Na+)=c(HCO-3)+2c(CO2-3 )
C.c(Na+)+c(H+)=c(HCO-3)+c(CO2-3 )+c(OH-)
D.c(HCO-3)>c(Na+)>c(H+)>c(OH-)
24、钠、镁、铝三种金属混合物与足量的稀硫酸充分反应,得标况下的气体2.24L,这三种金属的总物质的量可能是( )mol ( )
A.0.050 B.0.060 C.0.100 D.0.200
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com