
18.已知锌及其化合物的性质与铝及其化合物相似。如图,横坐标为溶液的pH,纵坐标为Zn2+离子或[Zn(OH)4]2-离子的物质的量浓度(假设Zn2+离子浓度为10-5mol·L-1时,Zn2+离子已沉淀完全)。下列说法不正确的是 ( ) 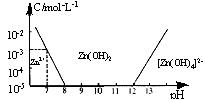
A.往ZnC12溶液中加入足量的氢氧化钠溶液,反应的离子方程式可表示为:
Zn2++4OH-=[Zn(OH)4]2-
B.从图中数据计算可得Zn(OH)2的溶度积Ksp=10-17mol3·L-3
C.某废液中含Zn2+离子,沉淀Zn2+离子可以控制溶液pH的范围是8-12
D.向1L 1mol·L-1ZnC12溶液中加入NaOH固体至pH=7,需NaOH 2mol
|
17.下列叙述正确的是 ( )
A.0.1mol·L-1氨水中,c(OH-)=c(NH4+)
B.10 mL 0.02mol·L-1HCl溶液与10 mL 0.02mol·L-1Ba(OH)2溶液充分混合,若混合后溶液的体积为20 mL,则溶液的pH=12
C.在0.1mol·L-1CH3COONa溶液中,c(OH-)=c(CH3COOH)+c(H+)
D.0.1mol·L-1某二元弱酸强碱盐NaHA溶液中,c(Na+)=2c(A2-)+c(HA-)+c (H2A)
16.一种甲醇、氧气和强碱溶液做电解质的新型手机电池,可连续使用一个月,其电池反应为:2CH3OH + 3O2 +4OH-
 2CO32-
+6H2O,则有关说法正确的是 ( )
2CO32-
+6H2O,则有关说法正确的是 ( )
A. 放电时CH3OH参与反应的电极为正极
B. 放电时负极的电极反应为CH3OH +8 OH- - 6e- = CO32- + 6H2O
C. 标准状况下,通入5.6LO2并完全反应后,有0.5mol电子转移
D. 放电一段时间后,通入氧气的电极附近溶液的pH降低
15.工业上制备纯硅反应的热化学方程式如下:SiCl4(g)+2H2(g)=Si(s)+4HCl(g); mol(Q>0),某温度、压强下,将一定量反应物通入密闭容器进行 以上反应(此条件下为可逆反应),下列叙述正确的是 ( )
mol(Q>0),某温度、压强下,将一定量反应物通入密闭容器进行 以上反应(此条件下为可逆反应),下列叙述正确的是 ( )
A.反应过程中,若压缩容器体积增大压强不能提高SiCl4的转化率
B.若反应开始时SiCl4为1 mol,则达平衡时,吸收热量为Q kJ
C.反应至4
min时,若HCl浓度为0.12
mol/L,则H2的反应速率为0.03 mol/(L min)
min)
D.当反应吸收热量为0.025Q kJ时,生成的HCl通入100 mL 1 mol/L的NaOH溶液恰好反应
14.下列说法正确的是 ( )
A.需要加热的化学反应都是吸热反应
B.中和反应都是放热反应
C.原电池是将电能转化为化学能的一种装置
D.水力发电是将化学能转化为电能的过程
13.短周期元素X、Y、Z的原子序数依次递增,其原子的最外层电子数之和为13。X与Y、Z位于相邻周期,Z原子最外层电子数是X原子内层电子数的3倍或者Y原子最外层电子数的3倍。下列说法正确的是 ( )
A.X的氢化物溶于水显酸性
B.Y的氧化物是离子化合物
C.Z的氢化物的水溶液在空气中存放不易变质
D.X和Z的最高价氧化物对应的水化物都是弱酸
12.埋在地下的输油铸铁管道,在下列各种情况下,被腐蚀的速度最慢的是 ( )
A.在潮湿疏松透气的土壤中 B.在干燥致密不透气的土壤中
C.在含铁元素较多的酸性土壤中 D.在含碳粒较多,潮湿透气的土壤中
|
A.一定温度、压强下,气体体积由其分子的大小决定
B.46gNO2和N2O4的混合物中含有的原子总数一定是3NA个
C.在标准状况下,含NA个氦原子(He)的氦气所含的分子数是0.5NA
D.25℃时,1 L pH=13的氢氧化钠溶液中含有NA个氢氧根离子
11.下列反应的离子方程式书写正确的是 ( )
A.小苏打溶液和甲酸溶液混合 HCO3-+HCOOH=HCOO-+CO2↑+H2O
B.铝片放入NaOH溶液中 2OH-+Al=AlO2-+H2↑
C.次氯酸钙溶液中通入过量二氧化碳 Ca2++2ClO-+CO2+H2O=CaCO3↓+2HClO
D.氨水中通入少量二氧化硫 2NH3·H2O+SO2=2NH4++SO32-+H2O
9.在H2S的水溶液中存在平衡:H2S  H+ + HS-,HS-
H+ + HS-,HS-  H+ + S2-,向H2S的水溶液中加少量NaOH固体,则c(S 2-)变化正确的是 ( )
H+ + S2-,向H2S的水溶液中加少量NaOH固体,则c(S 2-)变化正确的是 ( )
A.可能增大也可能减小 B.减小 C.增大 D.不变
8.在密闭容器中,反应X2(g)+Y2(g)  2XY(g);ΔH<0,达到甲平衡。在仅改变某一条件后,达到乙平衡,对此过程的分析正确的是 ( )
2XY(g);ΔH<0,达到甲平衡。在仅改变某一条件后,达到乙平衡,对此过程的分析正确的是 ( )

A.图Ⅰ是加入适当催化剂的变化情况 B.图Ⅱ是扩大容器体积的变化情况
C.图Ⅲ是增大压强的变化情况 D.图Ⅲ是升高温度的变化情况
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com