
17.(6分)请按下列线条提示,画出Fe、Cu、S、H2、HCl、NaOH、H2SO4、Ba(OH)2、NaHCO3、K2O、CuO、NaCl 的树状分类图:

15.LiAlH4( )、LiH是金属储氢材料又是有机合成中的常用试剂,遇水均能剧烈分解释放出H2,LiAlH4在125℃分解为LiH、H2和Al。下列说法不正确的是 ( )
)、LiH是金属储氢材料又是有机合成中的常用试剂,遇水均能剧烈分解释放出H2,LiAlH4在125℃分解为LiH、H2和Al。下列说法不正确的是 ( )
A.LiH与D2O反应,所得氢气的摩尔质量为4g/mol
B.1molLiAlH4在125℃完全分解,转移3mol电子
C.LiAlH4溶于适量水得到无色溶液,则化学方程式可表示为:LiAlH4+2H2O=LiAlO2+4H2↑
D.LiAlH4与乙醛作用生成乙醇,LiAlH4作还原剂
第Ⅱ卷(非选择题 共55分)
|
 12Na2CrO4 + 3Fe2O3
+7KCl + 12H2O,
12Na2CrO4 + 3Fe2O3
+7KCl + 12H2O,
试回答下列问题
(1)在反应器①中,有Na2CrO4生成,同时Fe2O3转变为NaFeO2,杂质SiO2、Al2O3与纯碱反应转变为可溶性盐,写出氧化铝与碳酸钠反应的化学方程式:
。
(2)NaFeO2能强烈水解,在操作②生成沉淀而除去,写出该反应的化学方程式: 。
(3)操作③的目的是什么,用简要的文字说明: 。

(4)操作④中,酸化时,CrO42-转化为Cr2O72-,写出平衡转化的离子方程式:
。
(5)称取重铬酸钾试样2.5000g配成250mL溶液,取出25.00mL于碘量瓶中,加入10mL 2mol/LH2SO4和足量碘化钾(铬的还原产物为Cr3+),放于暗处5min,然后加入100mL水,加入3mL淀粉指示剂,用0.1200mol/LNa2S2O3标准溶液滴定(I2+2S2O32-=2I-+S4O62-)。
判断达到滴定终点的依据是: 。
14.化学与数轴有密切的关系,将某些化学知识用数轴表示,可以收到直观形象、简明易记的良好效果。下列数轴表示的化学知识错误的是 ( )
A.分散系的分类
B.氯化铝溶液中滴加氢氧化钠溶液后铝元素的存在形式

C.铁和稀硝酸反应后溶液中铁元素的存在形式
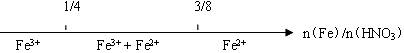
D.二氧化碳通入澄清的石灰水中反应的产物

13.有三种说法:①NH4NO3中氮元素显+5价; ②4FeS2+11O2 → 2Fe2O3+8SO2反应中+2价铁和-2价硫都被氧化;③氧化还原反应中还原剂得电子数与氧化剂失电子数一定相等。这三种说法中错误的是 ( )
A.① B.②③ C.①③ D.①②③
12.下列离子方程式正确的是 ( )
A.碳酸氢钠溶液与足量氢氧化钡溶液混合:HCO3-+Ba2++OH-→ BaCO3↓+H2O
B.亚硫酸氢铵和氢氧化钠的反应:NH4++OH-→ NH3↑+H2O
C.足量的溴化亚铁和少量的氯气反应:2Fe2++4Br-+3Cl2-→ 3Fe3++2Br2+6Cl-
D.碳酸氢镁溶液中加入足量的澄清石灰水:
Mg2++2HCO3-+ Ca2++2OH-→ Mg CO3↓+2CaCO3↓+2H2O
11.常温下的下列情况中,可以大量共存于同一溶液中的离子组是 ( )
A.使甲基橙呈红色的溶液中:I一、Cl一、NO3一、Na+
B.使石蕊呈蓝色的溶液中:NH4+、Al3十、NO3一、HCO3-
C.由水电离出的c(H+)=1 xl0-12mol·L一1的溶液中:K十、Cl一、NO3一、Na+
D.含有大量Al3十的溶液中:Na+、Mg2+、K十、ClO–
10.氮化铝(AlN)广泛用于电子工业、陶瓷工业等领域。可通过如下反应制取:
Al2O3+N2+3C 2AlN+3CO
2AlN+3CO
|
A.该反应中,Al2O3是氧化剂 B.该反应中,N2是还原剂
C.该反应中,C是还原剂 D.该反应中每生成2mol AlN,N2得到3mol e-
9.1986年,人们成功的用如下反应制得了氟:
①2KMnO4+2KF+10HF+3H2O2=2K2MnF6+8H2O+3O2 ②K2MnF6+2SbF5=2KSbF6+MnF4
③2MnF4=2MnF3+F2↑
下列说法中正确的是 ( )
A.反应①、②、③都是氧化还原反应
B.反应①H2O2既是还原剂又是氧化剂
C.氧化性:KMnO4>O2
D.每生成1mol F2,上述反应共转移2mol电子
8.离子检验的常用方法有三种:
|
检验方法 |
沉淀法 |
显色法 |
气体法 |
|
含义 |
反应中有沉淀产生或溶解 |
反应中有颜色变化 |
反应中有气体产生 |
下列离子检验的方法不合理的是 ( )
A.NH4+-气体法 B.I--沉淀法 C.Fe3+-显色法 D.Ca2+-气体法
7.向存在大量Na+、Cl-的溶液中通入足量的NH3后,该溶液中还可能大量存在的离于组是
( )
A.K+、Br-、CO32- B.Al3+、H+、MnO4-
C.NH4+、Fe3+、SO42- D.Ag+、Cu2+、NO3-
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com