
1、下列说法不正确的是( )
A、任何化学反应都伴随有能量变化
B、反应物总能量低于生成物的总能量时,该反应不能发生
C、反应物总能量高于生成物总能量时,发生放热反应
D、化石燃料在地球上的蕴藏量是有限的,而且又都是非再生能源
29.(6分)如图所示,用导线连接电极Fe、Pt和Pt、Cu置于烧杯A和B中,烧杯中装有相同浓度的CuSO4溶液。
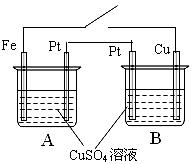
(1)闭合开关,电路中通过0.4mole- 时,求B烧杯中Pt电极上析出气体的体积(标况)。
(2)将B烧杯中Cu电极改为Zn电极,闭合开关,电路中通过0.4mole- 时,求B烧杯中
Zn电极的质量变化。
(要求:以上两问需指出A和B装置的作用,并有具体的计算过程。)
28.(5分)现有标况下67.2L水煤气(成分为H2和CO),在一定量O2中刚好完全燃烧,恢复至原温度和压强,体积变为44.8L。求该混合气体完全燃烧时放出的热量。
(已知:CO(g)+1/2
O2(g) CO2(g);△H=―283kJ/mol,
H2(g)+1/2 O2(g) H2O(l);△H=―285.8kJ/mol)
27.(8分)在如图用石墨作电极的电解池中,放入500mL含一种溶质的某无色溶液进行电解,一段时间后(电极反应未发生变化),观察到A电极表面有银白色固体物质生成,B电极有无色气体生成,体积为280mL(标况)。
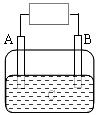
(1)B电极发生的电极反应方程式为
(2)电解后溶液pH为
(3)请设计实验验证原溶液中含有的阳离子,要求:写出一种可能的假设,写出验证假设的操作步骤,实验现象和结论。
26.(8分)某无色水溶液,由H+、Ca2+、NH4+、Na+、CO32-、NO3-、SO42-中若干组成,取该溶液进行如下实验。
①取适量溶液,加入足量NaOH溶液,加热,产生3.4g刺激性气味的气体。
②另取与①等体积的溶液,加入过量H2SO4溶液,产生2.24L气体(标况)。
③取②中反应后溶液,微热浓缩,再向其中加入少量Cu粉,产生红棕色气体。
④取③中反应后溶液,向其加入HCl酸化的BaCl2,有白色沉淀生成。
根据实验回答下列问题:
(1)写出实验①中产生气体的离子方程式:
(2)写出③中的化学方程式
(3)原溶液一定存在的离子是
一定不存在的离子是
25.(6分)电解精炼铜(所含杂质为Zn、Ag、Au),回答下列问题。
(1) (填“粗铜”或“精铜”)做阴极。
(2)阳极反应方程式为 。
(3)Ag、Au在阳极附近沉积,形成 。
(4)如果粗铜中Zn与Cu物质的量之比为1∶20,电解一段时间后,溶液质量增加0.02g,则阴极质量增加 g。
24.(9分)下图为相互串联的甲、乙两电解池试回答:
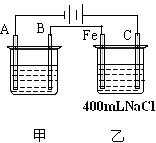
(1)若甲池利用电解原理在铁上镀银,则A是 (填电极材料),电极反应是 ;B是 (填电极材料)电极反应式是 ,应选用的电解质溶液是 。
(2)乙池中若滴入少量酚酞试液,开始电解一段时间, (填“C”或“Fe”)极附近呈红色。
(3)若甲槽阴极增重43.2g,则乙槽中阳极上放出的气体在标况下的体积是 mL。
23.(6分)将Mg片和Al片分别用导线连接在电流表的“+”“-”端,取50mL小烧杯两只,一烧杯中注入40mLH2SO4溶液,另一烧杯中注入40mLNaOH溶液。
(1)两电极同时插入H2SO4溶液,负极为 (填“铝”或“镁”)极,铝片上电极反应方程式为
(2)两电极同时插入NaOH溶液,负极为 (填“铝”或“镁”)极,铝片上电极反应方程式为
22.(4分)用NaCl做原料可以得到多种产品。
(1)工业上由NaCl制备金属钠的化学方程式是
(2)电解NaCl稀溶液可制备“84消毒液”,若所得消毒液仅含有一种溶质,写出相应的化学方程式
21.(8分)(1)目前常用的镍(Ni)镉(Cd)电池,其电池总反应可以表示为:
Cd+2NiO(OH)+2H2O 2Ni(OH)2+Cd(OH)2
2Ni(OH)2+Cd(OH)2
已知Ni(OH)2和Cd(OH)2均难溶于水但能溶于酸,以下说法中正确的是
① 以上反应是可逆反应 ② 以上反应不是可逆反应
③ 充电时化学能转变为电能 ④ 放电时化学能转变为电能
A.①③ B.②④ C.①④ D.②③
(2)废弃的镍镉电池在酸性土壤中严重污染环境,写出反应的离子方程式:
(3)另一种常用的电池是锂电池,电池中的电解质溶液需用非水溶剂配制,请用化学方程式表示其原因
(4)锂电池的总反应式为8Li + 3SOCl2 = 6LiCl + Li2SO3 + 2S,电池的正极反应方程式为
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com