
23.在120℃,1.01×105Pa时,将4mLO2和3mLNxHy(y>x)混合气体充入一密闭与容积可变的容器中,点燃充分反应,恢复到原温度和压强,测得容器中N2、O2、H2O混合气体密度减小3/10。
(1)试写出该反应的化学方程式为 。
(2)通过计算推断NxHy的分子式:
22.化学课外活动小组设计了如图所示的一套气体发生、收集和尾气吸收装置,以探究该装置的多功能性能。

(1)甲同学认为装置Ⅰ可作为实验室制氧气的快速发生器,则装置Ⅰ的a仪器中可加入 或 ,b仪器中加入 或 (与a中分别对应)。装置Ⅱ从 管口进气即可作为O2的收集装置。
(2)丙同学认为利用装置Ⅱ,可收集NO,试简述操作方法:
(3)戊同学认为利用装置Ⅰ和装置Ⅲ可进行验证Cl2的氧化性比Br2强的实验,进行此项实验时在装置Ⅰ中的a仪器中加入_________试剂,b仪器中加入____试剂,装置Ⅲ中应加入适量的 试剂,根据装置Ⅲ中观察到的 实验现象即可得出Cl2的氧化性比Br2强的结论。
★23.已知下列变化过程中,0.2mol的RxO42-完全参加反应时共转移0.4mol电子:
RxO42-+ MnO4-+H+→RO2+Mn2++H2O,
则(1)x的值和参加反应的H+的物质的量分别是
★23.向盐A2B溶液中加入盐CD2溶液有沉淀生成,为了研究这一化学反应,将两种盐分别配成0.1mol/L溶液进行实验,其有关数据如下表。(化学式中A、B、C、D表示原子或原子团,式量为A=23、B=96、C=137、D=35.5)
|
编号 |
A2B溶液体积(mL) |
CD2溶液体积(mL) |
沉淀质量(g) |
|
1 |
60 |
0 |
0 |
|
2 |
60 |
20 |
0.464 |
|
3 |
60 |
40 |
|
|
4 |
60 |
60 |
1.395 |
|
5 |
60 |
70 |
1.404 |
|
6 |
60 |
80 |
1.397 |
|
7 |
60 |
120 |
|
试回答:
(1)用A、B、C、D形式表示化学反应: ;
(2)沉淀的化学式为: ,理由是: ;
(3)3号实验中沉淀的质量为: g。
21.某化学兴趣小组测定某FeCl3样品(只含少量FeCl2杂质)中铁元素的质量分数,按以下实验步骤进行操作:
① 称取a g样品,置于烧杯中;
② 加入适量盐酸和蒸馏水,使样品溶解,然后准确配制成250.00mL溶液;
③量取25.00mL步骤②中配得的溶液,置于烧杯中,加入适量的氯水,使反应完全;
④ 加入过量氨水,充分搅拌,使沉淀完全;
⑤ 过滤,洗涤沉淀;
⑥ 将沉淀转移到某容器内,加热、搅拌,直到固体由红褐色全部变为红棕色后,在干燥器中冷却至室温后,称量;
⑦……。
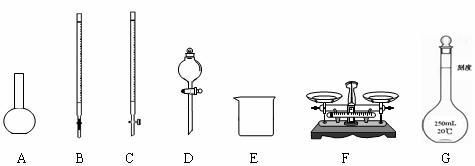
请根据上面叙述,回答:
(1)上图所示仪器中,本实验步骤①②③中必须用到的仪器是E和 (填字母)。
(2)写出步骤④中发生反应的离子方程式 。
(3)样品中的杂质Fe2+有较强的还原性,完成并配平下列反应的离子方程式
Fe2+ + ClO3- + = Fe3+ + Cl- + H2O
从理论上分析,上述实验中若将氯水改为NaClO3时,对实验结果造成 (填偏大、偏小或不影响),等物质的量的NaClO3与Cl2的氧化效率之比为
(4)第⑥步的操作中,将沉淀物转移到 (填仪器名称)中加热,冷却至室温,称量其质量为m1g,再次加热并冷却至室温称量其质量为m2g,若m1与m2差值较大,接下来的操作应当是 。
(5)本实验需要称量的最少次数是 次,若容器质量是W1 g,最终容器和固体的总质量是W2 g,则样品中铁元素的质量分数为 。(列出算式,不需化简)
20.有一瓶澄清溶液, 可能含有NH4+、K+、Mg2+、Ba2+、Al3+、Fe3+、SO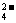 、CO
、CO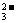 、NO
、NO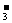 、
、
Cl-、I-现进行如下实验:
(1)测知溶液显强酸性;
(2)取样加少量四氯化碳和数滴新制氯水、CCl4层为紫红色;
(3)另取样滴加稀NaOH溶液, 使溶液变为碱性, 此过程无沉淀生成;
(4)取少量上述碱性溶液, 加Na2CO3溶液出现白色沉淀;
(5)将实验(3)中的碱性溶液加热, 有气体放出, 该气体能使湿红色石蕊试纸变蓝。
问:①原溶液中肯定存在的离子是 ;
②肯定不存在的离子是 ;
③不能确定是否存在的离子是 。
19.下列有关化学实验的正确组合是
① 用点燃的方法除去CO2中的CO
② 除去乙酸乙酯中少量乙酸,可用饱和碳酸钠溶液洗涤、分液、干燥、蒸馏
③ 用碱式滴定管量取20.00 mL 0.1000 mol / L KMnO4溶液
④ 配制100mL1.00mol/L的NaCl溶液时,可用托盘天平称取5.85g NaCl固体
⑤ 不慎将苯酚溶液沾到皮肤上,应立即用酒精清洗
⑥ 用瓷坩埚高温熔融Na2CO3
⑦ 物质溶于水的过程中,一般有放热或吸热现象,因此溶解的操作不能在量筒中进行
⑧ 浓硫酸、浓硝酸等强氧化性酸保存在带磨口玻璃塞的试剂瓶中
A.② ⑤ ⑦ ⑧ B.⑤ ⑦ ⑧ C.① ③ ⑤ ⑥ D.② ③ ④ ⑦
★20.某同学从一种未知的无色溶液中检验出Ag+、Ba2+,同时溶液的酸性很强,已知溶液中还可能大量存在的离子为Cu2+、Cl-、CO32-、S2-、K+、Al3+、SO42-、SO32-、NO3-中的一种或几种。很显然,有些离子不必检验便可得出结论,请简述理由
;你认为必须检验的离子是 。
18.在100 g浓度为10 mol·L-1、密度为ρ g·cm-3的氨水中加入一定量的水稀释成5 mol·L-1的氨水,则加入水的体积为
A.小于100 mL B.等于100 mL C.大于100 mL D.等于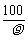 mL
mL
第Ⅱ卷 (非选择题,共66分)
17.配制一定体积、一定物质的量浓度的溶液,下列情况对实验结果产生偏低影响的是
A.容量瓶中原有少量蒸馏水 B.溶解使用的转移溶液后,玻璃棒、烧杯未洗涤
C.定容时仰视观察液面 D.定容时俯视观察液面
15.硫酸铝、硫酸钾、明矾三种物质组成的混和物中,当SO42-的浓度为0.20mol/L时,加入等体积的0.20mol/L的KOH溶液(混合后溶液体积变化忽略不计),使生成的白色沉淀恰好溶解,那么最后混合物中K+的浓度是
A.0.20mol/L B.0.25mol/L C.0.225mol/L D.0.45mol/L
★16.在100mL一定浓度的 FeBr2溶液中通入0.01 mol Cl2,充分反应后,有一半Br-变为Br2,原溶液中FeBr2溶液的浓度等于
A.0.01 mol•L-1 B.0. 1 mol•L-1 C. 0.075mol•L-1 D.0.08mol•L-1
16,有一定量的14% KOH溶液,加热蒸发掉100g水后,变为80 mL 28%的KOH溶液,此时溶液的物质的量浓度为
A.5mol/L B.6mol/L C.6.25mol/L D.6.75mol/L
14.能用离子方程式H+ + OH- = H2O表示的化学反应是
A.NaOH溶液和醋酸的反应 B.Ba(OH)2溶液和稀H2SO4的反应
C.NaOH溶液和硫酸氢钠溶液反应 D.氨水和稀H2SO4的反应
13.下列实验方案设计合理的是
A.鉴别氯化铝和氯化镁溶液:分别滴加过量的氢氧化钠溶液
B.除去氯化铵溶液中的氯化铁:向溶液中滴加适量氢氧化钠溶液,过滤
C.除去苯中的苯酚:向溶液中加入浓溴水,过滤
D.检验溴乙烷中的溴元素:在溴乙烷中滴入氢氧化钾溶液加热后,用稀硝酸酸化再滴加硝酸银溶液
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com