
7.下图是M、N两种物质的溶解度曲线,在t2℃时往盛有100g水的烧杯中先后加入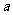 gM和
gM和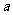 gN(两种物质溶解时互不影响,且溶质仍是M、N),充分搅拌,将混合物的温度降低到t1℃,下列说法正确的是 ( )
gN(两种物质溶解时互不影响,且溶质仍是M、N),充分搅拌,将混合物的温度降低到t1℃,下列说法正确的是 ( )

A.t1℃时,M、N的溶解度相等,得到M、N的饱和溶液
B.t2℃时,得到M的饱和溶液、N的不饱和溶液
C.t2℃时,M、N的物质的量浓度一定相等
D.t1℃时,M、N的溶质质量分数一定相等
6.下列叙述,能肯定判断某化学平衡发生移动的是 ( )
A.混合物中各组分的浓度改变 B.混合物中各组分的含量改变
C.正、逆反应速率改变 D.反应物的转化率改变
5.用一定量的铁与足量的CuO制单质铜,有人设计了以下两种方案:

若按实验原则进行操作,则两者制得单质铜的量为 ( )
A.一样多 B.①多 C.②多 D.无法判断
4.已知CH4(g)+2O2(g)=CO2(g)+2H2O(l);;△ H=-Q1 kJ/mol
2H2(g)+O2(g)= 2H2O(g);;△ H=-Q2 kJ/mol
2H2(g)+O2(g)= 2H2O(l);;△ H=-Q3 kJ/mol
取体积比4:1的甲烷和H2的混合气112L(标况),完全燃烧后恢复到常温,放出热量为 ( )
A.4Q1+0.5Q3 B.4Q1+0.5Q2 C.4Q1+Q3 D.4Q1+2Q2
3.下列有关化学反应方向的描述中不正确的是 ( )
A.一定条件下的可逆反应,反应物的转化率不可能达到100%
B.所有的氧化还原反应中,氧化剂的氧化性强于氧化产物的氧化性
C.沉淀转换的实质就是沉淀溶解平衡的移动,平衡一般向生成更难溶物质的方向移动
D.△H<0,△S>0的反应一定是自发进行的化学反应
2.下列选项中所涉及到的两个量的一定相等的是 ( )
A.11.2LCl2与4.25gNH3所含有的原子数
B.18.0g重水(D2O)与20gNe所含有的电子数
C.标准状况下36gH2O与1.204×1024个O2分子所占的体积
D.等物质的量的Al分别与足量的盐酸、NaOH溶液反应转移的电子数
1.2007年诺贝尔化学奖授予德国化学家格哈德·埃特尔是因为他在表面化学所作的研究。以下事实或现象与表面化学无密切关系的是 ( )
A.熔化的铝不易滴落下来
B.用还原铁粉和石棉绒混合物与水蒸气制得Fe3O4和H2
C.用明矾来净水
D.配制FeCl3 溶液时将FeCl3固体溶于浓盐酸中再加水稀释
22.(12分)已知在酸性条件下有以下反应关系:
①KBrO3能将KI氧化成I2或KIO3,其本身被还原为Br2;
2BrO-3+10I-+12H+ = 5I2 +Br2 + 6H2O 6BrO-3 +5I- +6H+ = 5IO-3+3Br2+3H2O
②Br2能将I-氧化为I2:Br2+2I- = 2Br-+I2
③KIO3能将I-氧化为I2,也能将Br-氧化成Br2,其本身被还原为I2。
IO-3+5I- + 6H+ = 3I2 + 3H2O 2IO-3 + 10Br-+12H+ = I2 + 5Br2 + 6H2O
(1)在上述反应涉及的粒子中氧化性最强的是 (填化学式,下同);
(2)在KI和KBr的混合溶液中,加入过量的KBrO3,其氧化产物为 ,还原产物为 ;
(3)向含有1mol KI的硫酸溶液中加KBrO3溶液,若反应后的碘元素只存在于I2中,溴元素只存在Br-中,则加入KBrO3的物质的量为 mol;
(4)将6mL 0.4mol·L-1KBrO3溶液和10mL 0.4mol·L-1KI溶液在稀H2SO4中混合。写出发生反应的离子方程式 。
21.(12分)实验室有一瓶Na2SO4固体,可能含有NaCl、Na2SO4、KNO3、K2CO3、K2SO4
中的一种或几种杂质,通过下列实验确定该样品的成分及Na2SO3的质量分数。
称此样品6.30g,加入6.0mol/L的硫酸至过量,产生无色气体560mL(标准状况),向逸出气体后的溶液中加入稍过量的BaCl2溶液,得到白色沉淀9.32g,透过蓝色钴玻璃观察,滤液的焰色反应无紫色。请根据实验填写下列空白:
(1)若用下图所示仪器组装进行上述实验,气流从左到右各仪器的正确连接顺序为(填编号字母) 接 , 接 , 接 ,液体X是 ,汽油的作用是 。

(2)若实验中加入硫酸溶液的体积为5.00mL,则样品Na2SO3质量分数是 ;样品中杂质的成分及其质量为 。
20.(12分)实验室常用铜片、稀硫酸和浓硝酸来制备五水硫酸铜:
Cu + 2HNO3 + H2SO4 = CuSO4 +2NO2↑+2H2O
分以下几个步骤:
①将4.5g铜屑的蒸发皿置于酒精灯火焰上,灼烧至表面呈现黑色,冷却;
②加16mL3mol·L-1硫酸,再缓慢、分批加入7mL 12mol·L-1硝酸(在通风橱进行);
③待反应缓和后,盖上表面皿,用水浴加热至铜屑全溶;
④倾析法趁热将溶液转移到另一蒸发皿中,并在水浴上浓缩到溶液出现少量晶体,冷却,过滤;
请回答下列问题:
(1)将铜屑灼烧,表面的黑色物质是 。
(2)加入硝酸时,必须缓慢、分批加入的目的是 。
(3)下图是硫酸铜和硝酸的溶解度表(单位:g),请根据表回答:
|
温度/℃ |
0 |
20 |
40 |
60 |
80 |
100 |
|
CuSO4·5H2O |
23.1 |
32.0 |
44.6 |
61.8 |
83.8 |
114.0 |
|
Cu(NO3)2·Xh2O |
83.5 |
125.0 |
163.0 |
182.0 |
208.0 |
247.0 |
①步骤④溶液冷却时析出的晶体主要是 。
②将所得晶体的粗产品提纯,通常采取的实验方法是 。
(4)实验中取用蒸发皿的仪器是 ,使用蒸发皿时的注意事项是 。(只需写出一项)
(5)步骤④中若不用水浴加热蒸发,所得晶体可能会因温度高转变为白色的粉末,此过程属于 变化。(填“物理”或“化学”)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com