
15.红钡钠(重铬酸钠:Na2Cr2O7·2H2O,橙红色晶体)是重要的化工原料。工业铬铁矿
(FeO·Cr2O3,含少量Al2O3和SiO2)按以下过程来制取红钒钠。

(1)步骤I的反应有:4FeO·Cr2O3+8Na2CO3+7O2=2Fe2O3+8Na2CrO4+8CO2,生成1molNa2CrO4转移的电子物质的量为 ;原料中加入CaCO3的作用是 ;
A.分解产生CaO,与某些杂质反应形成炉渣
B.分解时放出大量热量,提高煅烧温度
(2)浸取液中含有铝和硅的化合物,步骤III过滤前要用稀H2SO4将浸取液的pH调至7~8并煮沸除去铝和硅的化合物,其离子方程式为: 、 ;
(3)步骤IV离子反应方程式为 ,平衡常数表达式为:K= ;
(4)下图是Na2Cr2O7·2H2O和Na2SO4的溶解度曲线:
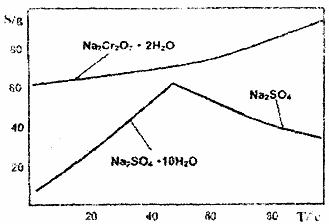
据此,步骤V操作的方法是:将IV所得溶液 (填操作),趁热过滤得到的晶体是(填化学式),然后将所得溶液 (填操作),得到的晶体是 。
14.工业焙烧重晶石BaSO4(s)+4C(s) 4CO(g)+BaS(s) △H1=571.2kJ·mol-1由此可以获得各种可溶性钡盐。如果BaSO4完全分解所需的能量由碳燃烧提供,则用1molBaSO4和10mol碳的混合物在空气中煅烧,完全反应后产生的气体中CO的体积分数不可能是(设空气中O2体积分数为0.21,N2为0.79) ( )
4CO(g)+BaS(s) △H1=571.2kJ·mol-1由此可以获得各种可溶性钡盐。如果BaSO4完全分解所需的能量由碳燃烧提供,则用1molBaSO4和10mol碳的混合物在空气中煅烧,完全反应后产生的气体中CO的体积分数不可能是(设空气中O2体积分数为0.21,N2为0.79) ( )
A.0.10 B.0.13 C.0.46 D.0.49
第Ⅱ卷(非选择题,共72分)
13.在高压下氮气会聚合生成高聚氮,晶体中的每一个氮原子都通过三根单键与其它氮原子结合并向空间发展构成立体网状结构。已知晶体中N-N单键的键能为160kJ/mol,而
N≡N叁键的键能为942kJ/mol,高聚氮可用作炸药与高能材料。下列说法正确的是
( )
A.高聚氮和氮气是同系物
B.高聚氮中每1mol氮原子有3mol N – N单键
C.氮气中每1mol氮原子有1mol N≡N叁键
D.高聚氮分解,每生成1mol氮气,放热462kJ
12.在标况下,将VLA气体(摩尔质量是Mg/mol)溶于1L水中,所得溶液的密度为dg/mL,则此溶液的物质的量浓度为 ( )
A. B.
B. C.
C. D.
D.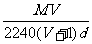
11.“芬必得”的有效成分是布洛芬,布洛芬的结构如下:

下列说法正确的是 ( )
A.分子式为C13H18O2
B.至少有9个碳原子共平面
C.1mol布洛芬最多能与5mol氢气发生反应
D.布洛芬有手性碳原子
10.已知:AgX(s) Ag+(aq)+X-(aq)的溶度积Ksp=c(Ag+)·c(X-),且pAg=-lgc(Ag+),
Ag+(aq)+X-(aq)的溶度积Ksp=c(Ag+)·c(X-),且pAg=-lgc(Ag+),
pX=-lgc(X-),种用pX – pAg的坐标系可表示出AgX的溶度积与溶液中的c(Ag+)和c(X-)的相互关系。某温度时,卤化银(AgX,X=Cl,Br,I)的三条沉淀溶解平衡曲线如下图所示,B线表示AgBr。下列说法错误的是 ( )

A.A线是AgCl,C线是AgI
B.三条线一定是平行的
C.d点是在水中加入足量AgBr形成的饱和溶液
D.e点表示是由过量的KI与AgNO3反应产生AgI沉淀
9.“神七”飞船发射成功,其燃料是偏二甲肼和四氧化二氮,发生如下反应:
(CH3)2NNH2(l)+N2O4(l)
 2CO2(g)+4H2O(g)+3N2(g)下列说法正确的是 ( )
2CO2(g)+4H2O(g)+3N2(g)下列说法正确的是 ( )
A.这是一个熵增反应
B.该反应△H>0
C.(CH3)2NNH2是氧化剂,N2O4是还原剂
D.该燃料是无毒,无污染的
8.某氯化镁溶液的密度为1.18g/cm3,其中Cl-离子的质量分数为15%,300mL该溶液中Mg2+离子的物质的量约等于 ( )
A.0.28mol B.0.56mol C.0.75mol D.1.5mol
7.在溶液中加入过量Na2O2后仍能大量共存的离子组是 ( )
A. 、Ba2+、Cl-、
、Ba2+、Cl-、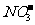 B.K+、
B.K+、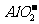 、Cl-、
、Cl-、
C.Ca2+、Mg2+、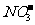 、
、 D.Na+、Cl-、
D.Na+、Cl-、 、
、
6.下列排列顺序正确的是 ( )
A.热稳定性:H2O>H2S>HCl B.离子半径:Na+>Mg2+>O2-
C.酸性:H2PO4>H2SO4>HClO4 D.结合质子能力:OH->CH3COO->Cl-
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com