
29.(13分)某核素R原子核内中了数比质子数多43,由它组成的固体单质A,在一定条件下密度为 ,用X射线研究其固体表明,在边长为
,用X射线研究其固体表明,在边长为 的立方体中含有20个原子。R在化学反应中常表现为+2价、+4价,在溶液中
的立方体中含有20个原子。R在化学反应中常表现为+2价、+4价,在溶液中 稳定,而R的+4价化合物具有强氧化性,可将NO氧化为
稳定,而R的+4价化合物具有强氧化性,可将NO氧化为 ,氧化物
,氧化物 其性质与
其性质与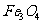 有些类似。请回答:
有些类似。请回答:
(1)R原子的摩尔质量为 (取整数)。
(2)R元素的核电荷数为 ,处于周期表中第 周期 族,其元素符号为 。
(3)溶液中不存在 ,假若能使少量
,假若能使少量 加到
加到 溶液中,是否会发生反应?
溶液中,是否会发生反应?
若“否”,其原因为: 。
若“是”,其离子反应方程式: 。
(4) 因具有氧化性,被大量用于油漆涂料,涂在钢铁表面,有利于形成耐腐蚀的钝化层。已知
因具有氧化性,被大量用于油漆涂料,涂在钢铁表面,有利于形成耐腐蚀的钝化层。已知 与足量
与足量 的反应,生成R的氧化物、R的硝酸盐和水三种物质,此反应的方程式为:
。
的反应,生成R的氧化物、R的硝酸盐和水三种物质,此反应的方程式为:
。
28.(16分)
(1)下列实验操作或叙述正确的是 (填写编号,多选扣分)
①不宜用瓷坩埚灼烧氢氧化钠或碳酸钠固体;
②为了提高纯锌与稀硫酸反应的速率,可向稀硫酸中滴入几滴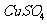 溶液;
溶液;
③用蒸馏水润湿的pH试纸测定溶液的pH一定有误差;
④向沸腾的NaOH稀溶液中滴加 饱和溶液,可以制得
饱和溶液,可以制得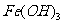 胶体;
胶体;
⑤配制硫酸溶液时,可先在量筒中加入一定体积的水,再在搅拌下慢慢加入浓硫酸;
⑥向饱和NaCl溶液中滴加浓硫酸制备HCl;
⑦亚硫酸钠与浓硫酸反应制备 。
。
(2)菠菜中有含铁元素的物质和乙二酸。乙二酸俗称草酸,易溶于水。其主要物理常数如下:
|
名称 |
分子式 |
颜色、状态 |
溶解性(g) |
熔点( ) ) |
密度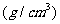 |
|
乙二酸 |
 |
无色固体 |
8.6 |
189.5 |
1.900 |
|
二水合乙二酸 |
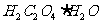 |
无色晶体 |
-- |
101.5 |
1.650 |
某化学小组同学为了研究草酸(乙二酸的结构HOOC-COOH)的化学性质,进行以下实验:
①该小组同学向盛有5mL硫酸酸化的0.5%(质量分数)的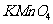 溶液的试管中滴加足量的乙二酸饱和溶液,振荡,观察到现象为
,写出该反应的离子方程式
;
溶液的试管中滴加足量的乙二酸饱和溶液,振荡,观察到现象为
,写出该反应的离子方程式
;
由此可推知乙二酸具有 (填“氧化性”或“还原性”);菠菜中铁元素的主要存在价态可能是 ;
②已知草酸分解的化学方程式为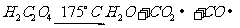 。该小组同学为了验证草酸受热分解的产物,设计了如图所示装置的实验。
。该小组同学为了验证草酸受热分解的产物,设计了如图所示装置的实验。

实验前,有同学提出用二水合乙二酸晶体进行实验,遭到大家的反对,其原因是 ;
有同学提出这个实验不能检验二氧化碳气体,还需在B、C之间加入4个洗气瓶,依次加入的试剂是 、 、 和浓硫酸,其中第3个洗气瓶的作用是 。
27.(13分)
(1)在一定条件下,氢气与氮气混合发生反应,下列有关说法正确的是 (填写编号,多选扣分)
①因为增大压强,反应速率加快,平衡正向移动,所以在工业生产中压强越大越好;
②降低温度,平衡正向移动,但是反应速率减慢,所以在工业生产中温度越低越好;
③使用铁触媒可以大大加快反应速率;
④将氨变成液体,及时从平衡混合气中分离出去,可以使平衡正向移动;
⑤增加氮气的浓度,可以提高氢气的转化率,但氮气的转化率会降低;
⑥可以选用的催化剂很多,且催化剂可以提高平衡转化率。
(2)在一个体积为1L的密闭容器中,充入1molA和3molB,发生如下反应:
A(g)+3B(g) xC(g),,平衡后,C的体积分数为W%;维持容器容积和温度不变,充入0.3molA、0.9molB和1.4molC为起始物质,达到平衡后,C的体积分数也为W%,则x可能的值为
。平衡后若缩小容器体积,达到新平衡后,与原平衡相比较,C的浓度 (填“增大”、“减小”或“不变”,下同),C的体积分数 ,正反应速率 。
xC(g),,平衡后,C的体积分数为W%;维持容器容积和温度不变,充入0.3molA、0.9molB和1.4molC为起始物质,达到平衡后,C的体积分数也为W%,则x可能的值为
。平衡后若缩小容器体积,达到新平衡后,与原平衡相比较,C的浓度 (填“增大”、“减小”或“不变”,下同),C的体积分数 ,正反应速率 。
26.(18分)
(1)有A、B、C、D、E五种微粒,它们都含有10个电子。通常状况下,微粒A和B为分子,C和E为阳离子,D为阴离子;B溶于A后所得的物质可电离出C和D;A、B、E三种微粒反应后可得C和一种白色沉淀。请回答:
①用化学符号填空:
B的结构式 ,C的电子式 。
②写出A、B、E三种微粒反应的离子方程式:
。
(2)甲、乙、丙、丁为前三周期元素形成的微粒,它们的电子总数相等。已知甲、乙、丙为双原子分子或负二价双原子阴离子,丁为原子。
①丙为钙离子组成的离子化合物跟水反应产生一种可燃性气体,该反应的化学方程式为: 。
②乙在高温时是一种还原剂,请用化学方程式表示它在工业上的一种重要用途: 。
③在一定条件下,甲与 反应的化学方程式是
。
反应的化学方程式是
。
④丁的元素符号是 ,它的原子结构示意图为 。
⑤单质丁的晶体熔点比金刚石的熔点 (填“高”或“低”)。
13.在前一种分散系中慢慢滴加后一种试剂,能观察到先沉淀后变澄清的是 ( )
①氯化铝溶液中滴加氢氧化钠溶液
②偏铝酸钠溶液中加盐酸
③氢氧化钠溶液中滴加氯化铝溶液
④蛋白质溶液中滴入硫酸铜溶液
⑤氯化铝溶液中滴加氨水
⑥硝酸银溶液中滴加氨水
⑦氢氧化铁胶体滴加硫酸
A.①②⑥⑦ B.②③⑤⑦ C.①②④⑥ D.③④⑤⑥
|
12.下列离子方程式中正确的是 ( )
A.过量的 与
与 溶液反应:
溶液反应:

B.苯酚钠溶液中通入少量 :
: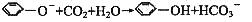
C. 溶液与过量NaOH溶液反应:
溶液与过量NaOH溶液反应: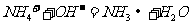
D. 溶液中通入过量
溶液中通入过量 :
:
11.在一闭容器中,反应Aa(g)+bB(g) Cc(g)+Dd(g)达到平衡后,保持温度不变,将容器的体积变为原来的一半,当达到新平衡时,A的浓度变为原平衡的1.5倍,则下列结论正确的是 ( )
Cc(g)+Dd(g)达到平衡后,保持温度不变,将容器的体积变为原来的一半,当达到新平衡时,A的浓度变为原平衡的1.5倍,则下列结论正确的是 ( )
A.平衡向逆反应方向移动了 B.物质B的转化率比原平衡时小
C.物质C的平衡浓度比原平衡小 D.
10.下列有关化学键与晶体结构说法正确的是 ( )
A.两种元素组成的分子中一定只有极性键
|
C.非金属元素组成的化合物一定是共价化合物
D.含有阴离子的化合物一定有阳离子
9.阿伏加德罗常数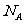 约为
约为 ,下列叙述中正确的是 ( )
,下列叙述中正确的是 ( )
A.1 mol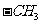 所含的电子数为7
所含的电子数为7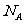
B.在含196
 的浓硫酸溶液中加入足量的锌粉使其充分反应,则反应结束时,生成的
的浓硫酸溶液中加入足量的锌粉使其充分反应,则反应结束时,生成的 分子数约为
分子数约为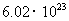 个
个
C.标准状况下,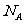 个
个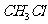 分子具有的体积约为22.4L
分子具有的体积约为22.4L
D.常温下含有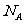 个
个 、
、 分子的混合气体,温度降至标准状况,其体积约为22.4L
分子的混合气体,温度降至标准状况,其体积约为22.4L
8.被誉为“太空金属”的钛,在室温下不与水、稀盐酸、稀硫酸和稀硝酸等作用,但易溶于氢氟酸,你认为其原因可能是 ( )
A.氢氟酸的酸性比其它酸强
B.氢氟酸的氧化性比其它酸强
C.氢氟酸的还原性比其它酸强
D.钛离子易与氟离子形成可溶性难电离物质
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com