
18.(9分)某课外活动小组设计如图所示装置,进行氯气的制备及有关性质实验。

(1)装置A中发生反应的离子方程式为 。
(2)上述装置中明显存在不足之处,为保证装置B中实验成功,应在装置A、B之间添加一个装置,该装置是 (填“I”、“Ⅱ”或“Ⅲ”)
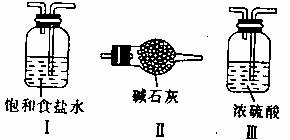
(3)装置C中溶液发生的颜色变化为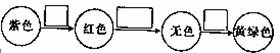
请在方框内填写出导致该阶段颜色变化的粒子符号。
(4)装置D中起始的实验现象是 。
(5)实验结束后,对装置A的烧瓶中残存的气体的处理方法是
。
17.(8分)现有A、B、C、D四种短周期非金属元素,它们的原子最外层电子数之和为19。在它们的化合物中,主要化合价均不止一种,但有一种相同的化合价。它们的一些物理常数如下:
|
元素 |
A |
B |
C |
D |
|
原子半径/nm |
0.102 |
0.077 |
0.117 |
0.075 |
|
单质沸点/℃ |
444.6 |
4827 |
2355 |
-195.8 |
(1)A元素在元素周期表中的位置为 。
(2)在常温下,B与C的最高价氧化物分别为气态和固态,原因是
。
(3)含D元素的两种常见共价化合物发生化合反应可生成一种离子化合物,该反应的化学方程式为 。
(4)A、B、C、D均可形成分子中含18个电子的氢化物,这些氢化物的分子式为
(写出3种即可)。
16.(7分)某一反应体系中有反应物和生成物共6种:HC1、H2SO4、SnC12、SnC14、FeSO4、Fe2(SO4)3,反应前在溶液中滴加KSCN溶液显红色,反应后红色消失。
(1)该反应的氧化剂是 。
(2)在该反应中,发生氧化反应的过程是 → 。
(3)写出该反应的化学方程式,并标出电子转移的方向和数目:
。
(4)SnC14与SnC12可用Hg2+来鉴别,HgC12与SnC12反应的产物是SnC14和Hg2C12(白色沉淀),该反应中还原剂与氧化剂的物质的量之比为 。
15.把一定量的Na2O2的NaHCO3的混合粉末分为两等份,将其中一份加入100mL稀盐酸中恰好完全反应,生成的气体干燥后体积为2.24L(标准状况下);再将此气体通入另一份混合物中,充分反应后,得到O2 2.016L(标准状况下),则原混合粉末中Na2O2和NaHCO3的物质的量之比及稀盐酸的物质的量浓度是 ( )
|
|
A |
B |
C |
D |
|
Na2O2和NaHCO3的物质的量之比 |
8:1 |
9:2 |
8:1 |
2:9 |
|
原稀盐酸的物质的量的浓度(mol·L-1) |
3.4 |
1.1 |
1.8 |
1.3 |
第Ⅱ卷(非选择题 共55分)
14.X+、Y+、M2+、N2-均匀含若干电子的短周期元素的简单离子,离子半径大小关系:N2->Y+、Y+>X+、Y+>M2+、M2+>X+。下列比较中正确的是 ( )
A.原子半径:N可能比Y大,也可能比Y小
B.M2+、N2-核外电子数:可能相等,也可能不等
C.原子序数:N>M>X>Y
D.碱性:M(OH)2>YOH
13.配制一定物质的量浓度的氢氧化钠标准溶液,用于测定未知浓度的盐酸,下列操作中会造成所测盐酸浓度偏低的是 ( )
A.所用烧碱已部分潮解
B.称量时法码放在左盘,并移动游码
C.定容后,溶液液面最高点与刻度线处在同一水平面上
D.向容量瓶中一次性转移氢氧化钠溶液
12.向盛有50mL 1.00mol·L-1HC1溶液的绝热容器中加入NaOH溶液,NaOH溶液的体积
(V)与所得混合溶液的最高测量温度(T)的关系如图所示,下列叙述中不正确的是 ( )

A.该实验表明化学能可以转化为热能 B.NaOH溶液的浓度大于1.00mol·L-1
C.V=50mL时,混合液的pH>7 D.该实验表明有水生成的反应都是放热反应
11.有一未完成的离子方程式为□ +XO3-+6H+==3X2+3H2O,据此判断,X元素的最高化合价为 ( )
+XO3-+6H+==3X2+3H2O,据此判断,X元素的最高化合价为 ( )
A.+1 B.+4 C.+5 D.+7
10.下列反应的离子方程式书写正确的是 ( )
A.碳酸钙溶于销酸:CO32-+2H+ CO2↑+H2O
B.向澄清石灰水中加入盐酸:Ca(OH)2+2H+ Ca2++2H2O
C.将铜片加入稀硝酸中:Cu+NO3-+4H+ Cu2++NO↑+2H2O
D.将小苏打溶液和乙酸混合:HCO3-+CH3COOH CH3COO-+CO2↑+H2O
9. 在两个密闭容器中,分别充有质量相等的甲、乙两种气体,它们的温度和密度均相同。试根据甲、乙的摩尔质量(M)的关系,判断下列说法中正确的是 ( )
A.若M(甲)>M(乙),则分子数:甲>乙
B.若M(甲)<M(乙),则气体摩尔体积:甲>乙
C.若M(甲)<M(乙),则气体的压强:甲>乙
D.若M(甲)>M(乙),则气体体积:甲<乙
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com