
17.(10分)利用天然气合成氨的工艺流程示意如下:
 P(s)+
P(s)+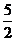 Cl2(g) PCl5(g);△H=-498.7kJ/mol。则PCl5(g)和Cl2(g)反应的热化学方程式为: 。
Cl2(g) PCl5(g);△H=-498.7kJ/mol。则PCl5(g)和Cl2(g)反应的热化学方程式为: 。
 (4)已知:P(s)+
(4)已知:P(s)+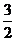 Cl2(g) PCl3(g);△H=-287.7kJ/mol,
Cl2(g) PCl3(g);△H=-287.7kJ/mol,
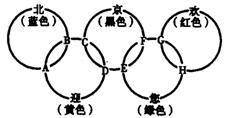
已知:蓝色的“北”是液态O2,红色的“欢”是固态非金属单质,1 mol G可与1 mol“您”恰好反应生成1 mol H,F的溶液可与A反应生成酸M、酸N和E的溶液,C高温煅烧可制得A,此反应是工业上制取酸M的基础反应。请回答下列问题:
(1)“京”是 ,“欢”的同素异形体是 。
(2)写出F的溶液与A反应生成酸M、酸N和E的溶液的化学方程式:
,该反应为氧化还原反应,还原产物为 。
(3)工业上以C为基础原料,制取酸M产生的工业尾气直接排放到大气中会造成环境污染,处理该尾气中以得到一种化肥,写出该肥料的化学式:
16.(8分)“北、京、欢、迎、您”分别代表五种不同颜色的单质,它们之间相互交叉形成了下图所示的奥运五环旗,A、B、C、D、E、F、G、H是由相交叉的两环元素组成的化合物。
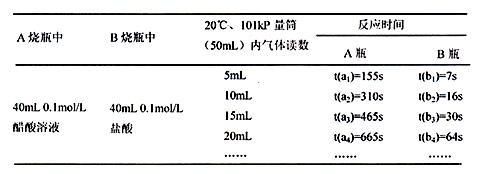
分析数据,观察实验装置图,回答下列问题:
(1)组装完成后,某同学发现该装置在设计上存在明显缺陷:根本无法完成实验,甚至存在危险,其缺陷在于
经小组研究后,稍作改进就可继续实验了;
(2)欲配置100mL实验所需浓度的盐酸,除烧杯、酸式滴定管、胶头滴管之外,还需用到的主要玻璃仪器是 ;
(3)在实验数据中
①t(a1)远远大于t(b1)的原因为: ;
②由 [用含t(b1)、t(b2)、t(b3)代数式表示]说明盐酸是强酸,不存在电离平衡;由 [用含t(a1)、t(a2)、t(a3)代数式表示]说明醋酸中存在电离平衡。
(4)该实验得到什么结论?(回答出两点即可)
①
②
(5)通过实验判断,锌与稀盐酸制氢气时,若要减慢反应速率而不影响产生氢气的量,可以加入 (填写两种不同作用原理的物质)。
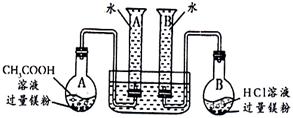 15.(10分)某校科技活动小组用镁粉、盐酸、醋酸设计以下实验,对两种酸分别与镁反应的速率和电离平衡理论进行研究,设计的实验装置如图所示(夹持固定装置已略去)。
15.(10分)某校科技活动小组用镁粉、盐酸、醋酸设计以下实验,对两种酸分别与镁反应的速率和电离平衡理论进行研究,设计的实验装置如图所示(夹持固定装置已略去)。
正确操作,记录得到下表中部分实验数据。
 14.某化学科研小组研究在其他条件不变时,改变某一条件对A2(g)+3B2(g)
14.某化学科研小组研究在其他条件不变时,改变某一条件对A2(g)+3B2(g) 2AB3(g)化学平衡状态的影响,得到如下图所示的变化规律(图中T表示温度,n表示物质的量),根据右图可得出的判断结论正确的是
2AB3(g)化学平衡状态的影响,得到如下图所示的变化规律(图中T表示温度,n表示物质的量),根据右图可得出的判断结论正确的是
A.正反应一定是放热反应
B.达到平衡时A2的转化率大小为:b>a>c
C.正反应一定是吸热反应,且T2>T1
D.b点时,平衡体系中A、B原子数之比接近1∶3
第II卷(非选择题 共72分)
A.若温度不变,容器体积扩大一倍,此时A的浓度是原来的0.48倍,则a+b大于c+d
B.若从正反应开始,平衡时,A、B的转化率相等,则起始时A、B的物质的量之比为a :b
C.若平衡体系中共有气体m mol,再向其中充入n molB,达到平衡时气体总物质的量为(m+n)mol,则a+b=c+d
D.若a+b=c+d ,则对于体积不变的容器,升高温度,平衡向左移动,容器中气体的压强不变
13.下列溶液中离子浓度的关系一定正确的是
A.Na2CO3和NaHCO3溶液中:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+c(CO32-)
B.一元弱碱MOH对应的盐MCl溶液中:c(Cl-)>c(H+)>c(M+)>c(OH-)
C.等物质的量的一元弱酸HX与其钾盐KX的混合溶液中:
D.pH=3的一元酸HX和pH=11的一元碱MOH等体积混合:
c(M+)=c(X-)>c(H+)=c(OH-)tesoon
12.对于平衡体系:aA(g)+bB(g) cC(g)+dD(g);正反应放热,有下列判断,其中正确的是
cC(g)+dD(g);正反应放热,有下列判断,其中正确的是
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com