
2.工业上冶炼金属一般用热分解法、热还原法和电解法。不同的金属应选用不同的冶炼方法。你认为选择的原则主要是依据
A.金属在自然界的存在形式
B.金属熔点的高低
C.金属离子得电子的能力
D.金属元素在地壳中的含量
1.2007年3月温家宝总理在十届全国人大五次会议上提出“要大力抓好节能降耗、保护环境”。下列举措与这一主题不吻合的是
A.用“绿色化学”工艺,使原料完全转化为产物
B.推广燃煤脱硫技术,防治SO2污染
C.推广垃圾的分类存放、回收、处理
D.大量使用农药化肥提高粮食产量
25.(10分)新型无机材料超细氮化铝粉末被广泛应用于大规模集成电路生产等领域。其制取原理是将氧化铝、氮气和焦炭(过量)在高温下反应,生成物中除目标产品外还有一种碳的氧化物。由于反应不完全,氮化铝产品中往往含有炭和氧化铝杂质。为测定该产品中有关成分的含量,进行了以下两个实验:
①称取20.00g样品,将其加入过量的KOH溶液中共热并蒸干,氮化铝跟氢氧化钾
溶液反应生成偏铝酸钾,并放出氨气6.72L(标准状况)。
②另取5.00g样品置于反应器中,通入1.008L(标准状况)O2,在高温下充分反应后,
测得气体密度为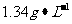 (已换算成标准状况,氮化铝不跟O2反应)。
(已换算成标准状况,氮化铝不跟O2反应)。
回答下列问题:
(1)写出制取氮化铝的化学方程式。
(2)写出①中反应的化学方程式。
(3)写出②中反应的总化学方程式。
(4)计算样品中杂质氧化铝的质量分数(保留三位有效数字)。
24.(8分)某资料说铁锈的成分为Fe2O3·H2O和FeCO3的混合物。根据此记载,某实验兴趣小组设计下列实验来验证其中是否含有碳酸亚铁。
①取一高度腐蚀的干燥铁钉,称其质量为10.04g,在氮气保护下.充分加热,冷却后称得质量为8.29g。
②将①得到的残渣投人到5.00 mol/L,的硫酸中,不断添加硫酸直至残渣完全溶解时,恰好用去硫酸31.00 mL。整个过程无气体放出。试回答下列问题:
(1)铁锈中是否含有碳酸亚铁?理由是什么?
(2)锈蚀的铁钉中含Fe2O3·H2O多少克?
(3)锈蚀前铁钉的质量至少多少克?
23.(10分)已知:
(1)同一个碳原子上连接两个羧基是不稳定的。
(2)碳碳双键有如下的断裂方式:

酯A(C6H10O3)可发生如下图所示的转化:

(1)写出A、D、G的结构简式
A D G
(2)指出相关转化过程的反应类型:
A→B+C D→E
(3)写出E转化为F的化学方程式 。
22.(8分)充分燃烧只含碳、氢、氧的一类有机物,消耗氧气的体积与生成二氧化碳的体积之比为9:8(相同条件下)。
(1)该类有机物最简通式是下列各式中的 (填字母代号)。
A.Cn(H2O)m B.(C2H3)n(H2O)m C.(C2H)n(H2O)m
D.(CH)n(H2O)m E.(C2O)n(H2O)m F.(CO)n(H2O)m
(2)若符合该通式的某有机物的相对分子质量为136,则其化学式为 ;若该有机物属于酯类且分子中含有苯环,则其可能的同分异构体有 种,写出其中任意两种的结构简式: ; .
21.(10分)某化学研究性学习小组存研究KClO3制取氧气。实验时查得如下资料:
资料一:KClO3单独加热到363℃时熔融.存380℃时发生两个反应:
①4 KClO3====3 KClO4+KCl ②KClO3====2 KCl+3O2↑
热至400℃以上时KClO4又发生分解.放出大量的O2。
资料二:若用MnO2作催化剂。则KClO3在200℃时就迅速分解.但制得的氧气中有氯气的气味.生成的氯化钾又略带紫红色,认为反应过程如下:
③2 KClO3+MnO2=== 2KMnO4+Cl2↑+O2↑
④2KMnO4=== K2MnO4+MnO2+O2↑
⑤Cl2+K2MnO4===2 KCl+MnO2+O2↑
资料三:部分物质的物理性质
|
物质 |
颜色和状态 |
密度/ |
0℃时溶解度/g |
100℃时溶解度/g |
|
|||||
|
KCl |
无色晶体 |
1.98 |
27.6 |
56.7 |
|
|||||
|
KClO4 |
无色晶体 |
2.32 |
3.3 |
57 |
|||||
|
KClO3 |
无色晶体 |
2.52 |
0.75 |
21.8 |
|
|||||
请回答下列问题:
(1)在KClO3与KClO4中,热稳定性较好的是 。
(2)单独加热KClO3制取氧气时,试管口应稍向 填(“上’’或“下”)倾斜,证明生成物中有KCl的方法是 。假设资料一中只发生反应①,则证明有KClO4生成的实验方法是 。
(3)若用MnO2作催化剂制取氧气,反应③中氧化产物是 (填化学式),按该反应过程,若制取l.5mol O2,总共有 mol电子发生转移。
(4)若用MnO2作催化剂加热KClO3时,两者质量比以MnO2占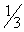 为最好。若用占
为最好。若用占 的MnO2和KClO3共热时,开始放出氧气较慢,继续加热至一定温度时,放出氧气的速率会很快,其主要原因可能是
的MnO2和KClO3共热时,开始放出氧气较慢,继续加热至一定温度时,放出氧气的速率会很快,其主要原因可能是
20.(10分)2003年10月17日晨6时许,载着航天英雄杨利伟的“神舟”五号飞船在内蒙古大草原成功着陆,我国首次载人航天飞行取得圆满成功。发射“神舟”飞船的长征2号火箭用了肼(N2H4)作燃料,N2H4与NH3有相似的化学性质。
(1)写出肼与盐酸反应的离子方程式: 。
(2)用拉席希法制备肼,是将NaClO和NH3按物质的量之比1:2反应生成肼,试写出该反应的化学方程式: ,该反应中 是氧化产物。
(3)发射火箭时肼(N2H4)为燃料,二氧化氮作氧化剂,两者反应生成氮气和气态水。已知4g N2H4(g)存上述反应中放出71kJ的热量.写出热化学方程式。
(4)为使宇航员有良好的生存环境,宇宙飞船中装有盛Na2O2颗粒的供氧装置,如用KO2(超氧化钾)代替Na2O2,能达到同样的目的。写出KO2与CO2反应的方程式: 。若仅从飞船携带物品宜轻便考虑,这两种物质中哪种更好.请用计算结果加以说明。
19.(8分)位于短周期的四种主族元素A、B、C、D原子序数依次增大,已知A、C位于同一主族,A在周期表中原子半径最小。B、D的最外层电子数相等,且B、D的原子序数之和为A、C原子序数之和的两倍。推断回答下列问题:
(1)写出由上述元素形成的具有漂白作用的四种物质的化学式: 、 、 、
(2)C与D形成D的最低价化合物的电子式: 。
(3)仅由B、C、D三种元素形成的一种盐,溶于水后呈碱性,请用一个离子方程式表示其呈碱性的原因: 。
18.(12分)某校化学兴趣小组的同学在进行研究性学习时,对“NO2能否支持燃烧”这个问题很感兴趣。他们决定自己动手设计实验进行探究。
(1)甲组同学设计的实验方案:向烧瓶中加入适量浓硝酸并加热,当烧瓶中有红棕色气体产生之后,将燃着的木条伸入烧瓶中,发现木条火焰熄灭。由此他们得出; “NO2不能支持燃烧”的结论。
甲组同学所得的结论一定正确吗?请说明理由:
(2)乙组同学通过查阅资料得知。一些不活泼金属的硝酸盐受热时也能产生NO2气体,如:2Cu(NO3)2 2CuO+4NO2↑+O2↑,2AgNO3
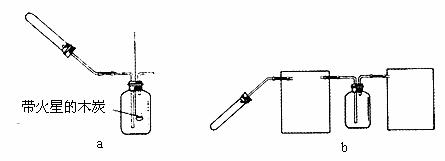
2CuO+4NO2↑+O2↑,2AgNO3 2Ag+2NO2↑+O2↑。他们根据此原理设计了如下图a所示的实验装置(加热、夹持仪器未画出),并分别用Cu(CO3)2和AgNO3。进行实验,实验中发现当红棕色气体进人集气瓶后,带火星的木炭均能复燃,乙组同学由此得出“NO2能支持燃烧”的结论。
2Ag+2NO2↑+O2↑。他们根据此原理设计了如下图a所示的实验装置(加热、夹持仪器未画出),并分别用Cu(CO3)2和AgNO3。进行实验,实验中发现当红棕色气体进人集气瓶后,带火星的木炭均能复燃,乙组同学由此得出“NO2能支持燃烧”的结论。
①老师认为上述两个实验中,有一个实验所得结论是不可靠的.你认为该实验中选用的反应物是 .其结论不可靠的原因是 ;
②运用该实验装置进行实验时.造成的不良后果是
(3)丙组同学拟设计一个用较为纯净的NO2气体(无O2产生)来探究“NO2能行支持燃烧”的实验。
①丙组同学制取NO2的化学方程式是 ;
②下图b是该组同学设汁的制取并收集NO2气体的实验装置,请在方框中将该装置补充完整.并注明补充装置中所用的试剂。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com