
5.下列离子方程式正确的是 ( )
A.C12与NaOH溶液反应:C12+2OH- C1-+C1O-+H2O
B.F2与NaOH溶液反应:F2+4OH- 2F2-+O2+2H2O
C.氯化钙溶液中通入适量二氧化碳:Ca2++CO2+H2O CaCO3↓+2H+
D.Fe3O4与稀HNO3反应:Fe3O4+8H+ Fe2++2Fe3++4H2O
4.为确定某溶液的离子组成,进行如下实验:
①测定溶液的pH,溶液显强碱性
②取少量溶液加入稀盐酸至溶液呈酸性,产生无刺激性、能使澄清石灰水变浑浊的气体;
③在上述溶液中再滴加Ba(NO3)2溶液,产生白色沉淀;
④取上层清液继续滴加Ba(NO3)2溶液至无沉淀时,再滴加AgNO3溶液,产生白色沉淀。
根据实验以下推测正确的是 ( )
A.一定有SO32- B.一定有CO32-
C.一定有C1- D.不能确定HCO3-是否存在
3.科学家发现,食用虾类等水生甲壳类动物的同时服用维生素C容易中毒,这是因为对人体无害的+5价砷类物质在维生素C的作用下,能够转化为有毒的+3价含砷化合物。下列说法不中正确的是 ( )
A.维生素C具有还原性
B.上述过程中砷元素发生还原反应
C.上述过程中+5价砷类物质作氧化剂
D.1mol +5价砷完全转化为+3价砷,共失去2mol电子
2.实验室需配制一种仅含四种离子(不包括水电离出的离子)的无色混合溶液,且在混合溶液中四种离子的物质的量浓度均为1mol·L-1。下面四个选项中能达到此目的的是( )
A.Na+、Mg2+、SO42-、C1- B.Cu2+、K+、SO42-、NO3-
C.H+、K+、HCO3-、C1- D.H+、Na+、MnO3-、S2-
1.按照下图所示的方法研究某气体的性质,这种方法属于 ( )

A.实验法 B.观察法 C.分类法 D.比较法
22.(4分)工业上常用漂白粉跟酸反应制得的氯气对漂白粉的质量分数(x%)来表示漂白粉的优劣。现为测定一瓶漂白粉的x%,进行如下实验:称取漂白粉样品2.00g,加水研磨后转入250mL容量瓶内,用水稀释至刻度。摇匀后,取出25.0mL,加入过量的KI溶液和过量的稀硫酸,静置待漂白粉放出的氯气与KI完全反应后,加入0.100mol·L-1的Na2S2O3溶液20.00mL,恰好与生成的碘完全反应:
2Na2S2O3+I2=Na2S4O6+2NaI
(1)试写出漂白粉与稀硫酸反应的化学方程式 。
(2)试由上述数据计算该漂白粉的x%为 。
21.(8分)某溶液由Na+、Cu2+、Ba2+、Fe3+、AlO2-、CO32-、SO42-、Cl-中的若干种离子组成,取适量该溶液进行如下实验:

根据上述实验回答下列问题:
(1)气体A的化学式是 ,白色沉淀B的摩尔质量是 。
(2)生成沉淀C的离子方程式是 。
(3)原溶液中一定不存在的离子是 。
20.(14分)某校学生课外活动小组为测定Na元素的相对原子质量,设计的装置如下图,从实验室取出bg(不足量)的钠放入水中,塞紧瓶塞,使钠完全反应,试回答:
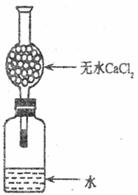
(1)实验室取用一小块钠,需要的用品有 。
(2)此干燥管的作用是 ,若不用些干燥管,则测出相对原子质量会比实际相对原子质量 (填“偏大”、“偏小”或“不变”,下同),若此钠块有极少量被氧化,则结果会 。
(3)有甲同学建议在图中干燥管上再第二个干燥管(设此干燥质量为mg,包括干燥刘的质量),其目的是 ,称得反应前装置(包括水和干燥剂)的总质量为ag。完全反应后再称量此装置的总质量为cg,且第二个干燥管质量变为m1g,则依甲同学建议,计算钠的相对原子质量的表达式为 。
(4)有乙同学为避免由于行动不够迅速产生偏差,又建议在广口瓶中再加入一定量煤油,其目的是 。
19.(10分)(1)配平氧化还原反应方程式:
C2O42-+ MnO4-+ H+= CO2+ Mn2++ H2O
(2)称取6.0g含H2C2O4·2H2O、KOH、KHC2O4和K2SO4的试样,加水溶解,配成250mL溶。量取两份此溶液各25mL,分别置于两个锥形瓶中。
①第一份溶液中加入酚酞试液,滴加0.25mol/LNaOH溶液至20mL时,溶液由无色变为浅红色。该溶液被中和的H+的物质的量为 mol。
②第二份溶液中滴加0.10 mol/L的酸性高锰酸钾溶液至16mL时反应完全,此时溶液颜色 。该溶液中还原剂的物质的量为 mol。
③原试样中H2C2O4·2H2O的质量分数为 。
18.(6分)已知固体混合物A由NaHCO3,KHCO3,MgCO3,CaCO3四种物质中的两种混合而成。取A与足量的盐酸反应,请通过计算和推理回答下列问题:
(1)若n(A)为定值,生成气体的量即为定值,则A的组成可能有 种。
(2)若m(A)为定值,生成气体的量即为定值,则A的可能组成是 (填写化学式)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com