
20.(6分)以 、
、 、
、 、
、 、
、 这五种离子恰当地组成电解质,按下列要求进行电解。请填写相应的溶质(只写一种)。
这五种离子恰当地组成电解质,按下列要求进行电解。请填写相应的溶质(只写一种)。
(1)以惰性电极电解时,原溶质质量不变,水量和pH都变小:__________。
(2)以石墨为电极电解时,电解质质量减小,水量和pH几乎都不变:__________。
(3)以石墨为阳极、铁为阴极电解时,原溶质、水量pH都变小:__________。
19.(14分)如下图所示,甲池中电池反应式为 ,已知B电极质量不变,C、D为石墨电极,乙池中为200mL饱和NaCl溶液。回答下列问题:
,已知B电极质量不变,C、D为石墨电极,乙池中为200mL饱和NaCl溶液。回答下列问题:

(1)A极为__________极(填“正”或“负”),电极材料为__________;发生__________反应(填“氧化”或“还原”)。
(2)写出乙池电极反应式
阳极反应式:________________________________________;
阴极反应式:________________________________________。
(3)C电极上产生的气体在标准状况下的体积为__________升。
(4)在实验室中,欲从甲池反应后的废液中回收铜,并重新制得纯净的FeCl3溶液,简述操作步骤及有关反应原理(用离子方程式表示)______________________。
18.(16分)氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得: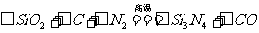
(1)配平上述反应的化学方程式(将化学计量数填在方框内);
(2)该反应中的氧化剂是__________,其还原产物是__________;
(3)该反应的平衡常数表达式为K=__________;
(4)若知上述反应为放热反应,则其反应热△H__________零(填“大于”“小于”或“等于”);升高温度,其平衡常数值__________(填“增大”“减小”或“不变”);
(5)若使压强增大,则上述平衡向__________反应方向移动(填“正”或“逆”);
(6)若已知CO生成速率为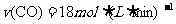 ,则N2消耗速率为
,则N2消耗速率为
17.(8分)0.3mol气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固三氧化二硼和液态水,放出649.5kJ的热量,其热化学方程式为_______________________________;又已知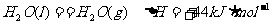 ,则11.2L(标准状况)乙硼烷完全燃烧生成气态水时放出的热量是__________。
,则11.2L(标准状况)乙硼烷完全燃烧生成气态水时放出的热量是__________。
16.近年来,加“碘”食盐较多使用了碘酸钾,KIO3在工业上可用电解法制取,以石墨和铁为电极,以KI溶液为电解液在一定条件下电解,反应方程式为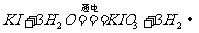 。下列有关说法中,不正确的是
。下列有关说法中,不正确的是
A.电解时,石墨做阳极,铁做阴极
B.电解时,在阳极上产生氢气
C.电解后得到KIO3产品的步骤有:浓缩→结晶→干燥
D.电解中,每转移0.6mol电子,理论上可得到0.1mol无水KIO3晶体
15.据报道,某公司最近研制了一种由甲醇和氧气以及强碱作电解质溶液的新型手机电池,电量可达现用镍氢电池或锂电池的10倍,有关此电池的叙述错误的是
A.正极电极反应式:
B.负极电极反应式:
C.电池在使用过程中,电解质溶液的pH降低
D.当外电路通过1.2mol电子时,理论上消耗甲醇6.4g
14.两只串联的电解池,左池放CuSO4溶液,右池放一定量的硝酸盐稀溶液,电解时,当左池析出1.6g铜时,右池析出5.4g固体,则右池中的溶质为
A.AgNO3 B.NaNO3 C.Mg(NO3)2 D.Al (NO3)2
13.把锌片和铁片放在盛有稀食盐水和酚酞试液的玻璃皿中(如下图),经过一段时间后,首先观察到溶液变红的区域是
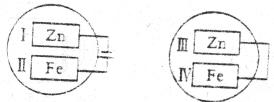
A.Ⅰ和Ⅲ附近 B.Ⅰ和Ⅳ附近 C.Ⅱ和Ⅲ附近 D.Ⅱ和Ⅳ附近
12.有关X、Y、Z、W四种金属进行如下实验:
|
① |
将X与Y用导线连接,浸入电解质溶液中,Y不易腐蚀 |
|
② |
锌片状的X、W分别投入等浓度盐酸中都有气体产生,W与X反应剧烈 |
|
③ |
用惰性电极电解等物质的量浓度的Y和Z的硝酸盐混合溶液,在阴极上首先析出单质Z |
根据以上事实,下列判断或推测错误的是
A.Z的阳离子氧化性最强
B.W的还原性强于Y的还原性
C.Z放入CuSO4溶液中一定有Cu析出
D.用Y、Z和稀硫酸可构成原电池,且Y作负极
11.下列关于电解的叙述中不正确的是
A.电解池的阳极发生氧化反应,阴极发生还原反应
B.电解饱和食盐水时,阳极得到氢氧化钠溶液和氢气
C.电解法精炼粗铜,用纯铜作阴极
D.在镀件上电镀锌,用锌作阳极
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com