
6.下列判断正确的是( )。
A.冰熔化时,分子中H-O键发生断裂
B.白磷与红磷在一定条件下可互相转化,发生的变化属于物理变化
C.酸性氧化物在固态时,一定是分子晶体
D.三氧化硫晶体熔化时,一定没有破坏化学键
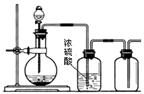 A.用MnO2和浓盐酸制备Cl2
A.用MnO2和浓盐酸制备Cl2
B.用铜和稀硝酸制备NO
C.用30% H2O2水溶液和MnO2制备O2
D.用锌和稀硫酸制备H2
5.可以用下图所示装置制备、干燥、收集的气体是( )。
4.随着科学技术的不断进步,研究物质的手段和途径越来越多,N5+、H3、O4、C60等已被发现。下列有关说法中,正确的是( )。
A.N5+离子中含有36个电子 B.O2与O4属于同位素
C.C60属于原子晶体 D.H2与H3属于同素异形体
3.下列有关说法正确的是( )
A.合成氨工业与接触法制硫酸中的SO2的催化氧化过程中都采用了高压的生产条件
B.结构陶瓷碳化硼(B
C.制造光缆的主要材料是单质硅
D.氟利昂和氮氧化物(NOX)都能破坏臭氧层,从而导致“温室效应”
2.北京2008奥运会金牌直径为
A.硫酸铜溶液 B.氢氧化钠溶液 C.稀硝酸 D.硝酸银溶液
1.在已处于化学平衡状态的体系中,如果下列量发生变化,其中一定能表明平衡发生移动的是( )。
A.反应混合物的浓度 B.反应物的转化率
C.正.逆反应速率 D.反应混合物的压强
 族
族
周期
I A
II A
III A
IV A
V A
VI A
VII A
一
二
a
b
d
e
三
f
g
h
j
(1)表中元素的单质中熔点最高的可能是___(填元素符号);写出a的氯化物的电子式 ;e、f、h形成的简单离子的半径由大到小顺序依次为______________(填离子符号);
(2)在一定条件下,j与d可形成一种化合物,常温下为淡黄色液体,则其晶体类型为__;该物质遇水强烈水解,生成两种产物,其中之一的分子构型为三角锥形,另一种物质具有漂白性,写出相关反应的化学方程式___________________________;
(3)现有一种元素,其原子获得一个电子所释放出能量是上表中所列元素中最大的,该元素是表中_____元素(填编号);
(4)在g的单质中添加f单质,形成物质k,则g、f、k中硬度最大的是_____(填物质名称)。
(5)若制得117号元素,按元素周期表中金属与非金属的分区,它应是一种
(选填“金属”“非金属”)元素,写出117号元素最外层电子排布式 。
(6)试用短周期元素,写出两种中心原子杂化轨道类型不同的AB3型分子的化学式
、 。
21.下表是元素周期表的一部分。
5.516
回答下列问题:
(1)第2次实验中产生沉淀质量是多少,将结果填入表格空白处。
(2)Ba(OH)2溶液中溶质的物质的量浓度是 。
(3)第2次实验样品中NaHCO3的物质的量是 。
(4)室温下取第2组实验所得溶液体积的1/10,加水配成500mL溶液,求稀释以后溶液的pH?(要求书写计算过程)
八、(本题包括1小题,共12分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com