
6.NA表示阿伏加德罗常数,下列说法正确的是 ( )
A.16g CH4与18 g NH 所含质子数相等
所含质子数相等
B.1mol 苯分子中含有碳碳双键数为3NA
C.将分子总数为NA的NH3和HCl的混合气体置于标准状况下,其体积为约22. 4L
D.等物质的量的甲基(-CH3)和羟基(-OH)所含电子数相等
5.存放下列试剂的方法中,有错误并且会引起危险的是 ( )
A.白磷浸在盛有CS2的敞口试剂瓶中 B.金属钠浸在盛有煤油的试剂瓶中
C.浓硝酸存放在棕色试剂瓶中 D.溴水放在带橡皮塞的试剂瓶中
4.古诗词是古人为我们留下的宝贵精神财富,下列诗句不涉及氧化还原反应的是( )
A.野火烧不尽,春风吹又生 B.春蚕到死丝方尽,蜡炬成灰泪始干
C.粉身碎骨浑不怕,要留青白在人间 D.爆竹声中一岁除,春风送暖入屠苏
3.下列反应中生成物总能量高于反应物总能量的是 ( )
A.碳酸钙受热分解 B.乙醇燃烧
C.铝粉与氧化铁粉末反应 D.氧化钙溶于水
2.下列仪器①漏斗②容量瓶③蒸馏烧瓶④天平⑤分液漏斗⑥滴定管⑦燃烧匙。常用于物质分离的是 ( )
A.①③④ B.①②⑥ C.①③⑤ D.③④⑦
1. 使用化学手段可以消除某些环境污染。下列主要依靠化学手段消除环境污染的是 ( )
A.在燃煤中添加生石灰 B.将某些废旧塑料融化后再成型
C.把放射性核废料深埋于地下岩层 C.用多孔吸附剂清除水面油污
23.(共7分)铜合金是人类使用最早的金属材料,铜在化合物中的常见化合价有+l 、+2。已知Cu2O与稀硫酸反应,溶液呈蓝色。现向Cu、Cu2O和CuO组成的混合物中,加入1 L 0.6 mol/L HNO3溶液恰好使混合物溶解,同时收集到2240 mL NO气体(标准状况)。请回答下列问题:
(1)写出Cu2O跟稀硝酸反应的离子方程式 。
(2)若将上述混合物用足量的H2加热还原,所得到固体的质量为 。
(3)若混合物中含0.1 mol Cu,将该混合物与稀硫酸充分反应,至少消耗H2SO4的物质的量为 。
(4)若混合物中Cu的物质的量为n mol,则n的取值范围为 。
22.(共9分)某课外活动小组同学用下图装置进行实验,试回答下列问题。
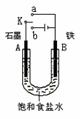
(1)若开始时开关K与a连接,则B极的电极反应式为 。
(2)若开始时开关K与b连接,则B极的电极反应式为 , 总反应的离子方程式为 。
有关上述实验,下列说法正确的是(填序号) 。
①溶液中Na+向A极移动
②从A极处逸出的气体能使湿润KI淀粉试纸变蓝
③反应一段时间后加适量盐酸可恢复到电解前电解质的浓度
④若标准状况下B极产生2.24 L气体,则溶液中转移0.2 mol电子
(3)该小组同学模拟工业上用离子交换膜法制烧碱的方法,那么可以设想用如下图装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾。
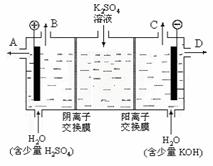
①该电解槽的阳极反应式为 。此时通过阴离子交换膜的离子数 (填“大于”或“小于”或“等于”)一通过阳离子交换膜的离子数。
②制得的氢氧化钾溶液从出口(填写“A”、“B”、“C”、“D”) 导出。
③通电开始后,阴极附近溶液pH会增大,请简述原因 。
④若将制得的氢气、氧气和氢氧化钾溶液组合为氢氧燃料电池,则电池正极的电极反应式为 。
21.(共6分)某实验小组用0.50 mol/L NaOH溶液和0.50 mol/L硫酸溶液进行中和热的测定。
Ⅰ.配制0.50 mol/L NaOH溶液
(1)若实验中大约要使用245 mL NaOH溶液,至少需要称量NaOH固体 g。
(2)从下图中选择称量NaOH固体所需要的仪器是(填字母): 。

Ⅱ.测定中和热的实验装置如下图所示。

(1)写出稀硫酸和稀氢氧化钠溶液反应表示中和热的热化学方程式(中和热数值为57.3 kJ/mol): 。
(2)取50 mL NaOH溶液和30 mL硫酸溶液进行实验,实验数据如下表。
①请填写下表中的空白:
|
温度 实验次数 |
起始温度t1/℃ |
终止温度t2/℃ |
温度差平均值(t2-t1)/℃ |
||
|
H2SO4 |
NaOH |
平均值 |
|||
|
1 |
26.2 |
26.0 |
26.1 |
30.1 |
|
|
2 |
27.0 |
27.4 |
27.2 |
33.3 |
|
|
3 |
25.9 |
25.9 |
25.9 |
29.8 |
|
|
4 |
26.4 |
26.2 |
26.3 |
30.4 |
②近似认为0.50 mol/L NaOH溶液和0.50 mol/L硫酸溶液的密度都是1 g/cm3,中和后生成溶液的比热容c=4.18 J/(g·℃)。则中和热△H= (取小数点后一位)。
③上述实验数值结果与57.3 kJ/mol有偏差,产生偏差的原因可能是(填字母) 。
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
20.(共8分)A和R在一定条件下可合成芳香族化合物E,已知A可以在一定条件下转化为G,且G在标准状况下密度为1.25 g/L。各物质间相互转化关系如下图所示(某些条件已略去)。
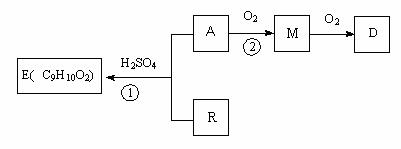
(1)A中所含官能团的名称为 ;①的反应类型为 。
(2)②的化学反应方程式为 。M与新制氢氧化铜悬浊液反应的化学方程式 。
(3)与E具有相同官能团,且苯环上只有一个取代基的同分异构体还有5种,它们是:
 、
、  、
、 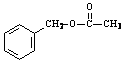
_________ _、 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com